ゲスト寄稿 | 「ナノダイヤモンド」と「がん治療研究」
ナノ粒子を用いたがん治療研究について解説します。
Veronika Benson著
「ナノ」研究のどこが特別なのでしょうか?
実際のところ、ナノ粒子は、単にサイズが小さいだけです。ナノ粒子は、生細胞に入り込めるくらいの小ささですが、相当量の低分子医薬を負荷して運搬する能力を有し、ナノ粒子内に発光中心を注入することもできます。従来のマクロスケールの材料と比較して、ナノ材料は特殊な光電子工学的特性、力学的特性、磁力特性を有しています。比較的表面積が大きいので、あらゆる種類の高分子が結合できる反応基を数多く提供します。こうした特性すべてから、核酸、タンパク質、膜類、細胞小器官、さらには細胞全体等、あらゆる種類の生体内物質との独特な相互作用が生じます。相互作用の種類や効果は、さらに、各ナノ粒子のコロイド特性、相互作用する生体内物質の特性、ナノ粒子表面と相互作用する対象物との間の熱力学的変化等にも依存します。科学的に大きな関心が寄せられているのは、薬物送達(ドラッグデリバリー)剤としてのナノ粒子の利用です。当初、リポソームやポリマーナノ粒子の研究が進められ、数十年経過した現在もこれらの素材を使用したがん治療に関連する若干数の臨床試験が進行中です。特に遺伝子治療に関連して、全く新しい治療法が考案されつつあります。初めて成功したヒトでの臨床試験は、2010年にNature誌に発表されました(1)。その試験で、Davisらは、腫瘍細胞を標的とするためのトランスフェリン‐PEG(ポリエチレングリコール)結合体と、リボヌクレオチド還元酵素特異的siRNAで修飾したシクロデキストリンベースのポリマーナノ粒子を使用しました。この複合体(直径約70nm)を、転移性メラノーマ患者に静脈内投与したところ、治療用複合体は腫瘍に蓄積し、標的とするmRNAとタンパク質の発現量が低下しました。この発表は、ナノ粒子による全身投与型siRNAデリバリーによって、ターゲット腫瘍細胞のRNA干渉が誘発されることを示した最初の報告です。
がん研究におけるナノダイヤモンド
新たな診断・治療用デリバリーシステムの基礎研究や応用研究により重要な事実が得られつつあります。標的部位で効率的に取り込まれる、薬物動態、生分解性、薬物分布が良好である等、理想的な特性を有する薬物キャリアを特定するべく、新たなデリバリーシステムが模索されています。最近では、無機材料の生理化学的特性が、診断・治療用のデリバリー手段としての使用に適していることから、無機材料の人気が高まっています。ナノダイヤモンドは、新規の炭素材料であり、生命システムと高い適合性を示すとともに、その他の有益な特性を有します。その優れた生体適合性に加えて、様々な薬物、イメージング試薬、核酸、タンパク質を結合して送達できる高い汎用性があります。また、この材料は、商業生産用に容易にスケールアップすることができます(2)。よく見かけるダイヤモンドの装飾ジュエリーとは対照的に、ナノダイヤモンド(主に粒子径約5nm)は、カーボンを含有する爆薬の爆発による安価な大規模合成によって製造することができます。超ナノ微結晶ナノダイヤモンド粒子(1~150nm)は、高圧高温法を用いて製造されます。製造法の種類によって、ナノダイヤモンドのサイズ、形状、および表面特性が決まり、得られたナノダイヤモンドは、特定の用途に用いるために更に加工することができます。特にナノダイヤモンドは、がん治療研究において薬物送達剤やリアルタイムイメージング用のセンサーとして利用されています。これまでのところ、がん治療や診断へのナノダイヤモンドの応用研究に関して、84報の論文が発表されています。そのほとんどが、ドキソルビシン、パクリタキセル、シスプラチン等の既存の薬剤とナノダイヤモンドを組み合わせて使用する方法に関する研究です。ナノダイヤモンドは、コロイド分散液として使用されるか、ポリマーグリッドに埋め込まれた状態で使用されます。いくつかの研究では、ナノダイヤモンドをさらにターゲット分子や細胞膜透過ペプチドTAT(Trans-Activator of Transcription Protein)でコーティングすると、より効果的な抗がん作用が得られたと述べられています。その後、核酸を送達するナノダイヤモンドに関する研究が登場しました。こうした研究では、ほとんどの場合、核酸をポリマーコーティングまたはアンカーを介して連結させています。
がん治療におけるナノダイヤモンドの使用に関する最初のエビデンスは、2010年にGuanらによって発表されました(3)。著者らは、ナノダイヤモンドによるシスプラチンの送達と細胞内の酸性環境下でのシスプラチンの放出によって、ヒト子宮頸癌細胞(Hela細胞株)の増殖が抑制されたことを報告しました。2011年、Chowら(4)は、乳腺腫瘍や肝臓がん等の治療抵抗性がんへのナノダイヤモンドを介したドキソルビシンの送達について述べています。この論文でもナノダイヤモンドが腫瘍へ薬物を送達できることが示されていますが、こうしたアプローチでは治療の有効性も向上しています。ドキソルビシン修飾ナノダイヤモンドの使用により、これまで腫瘍抵抗性の要因となっていた薬物排出を克服しました。薬物送達の影響を受けた腫瘍細胞はアポトーシスを起こし、従来のドキソルビシン単剤療法に比べて、腫瘍の増殖が有意に抑制されました。ドキソルビシンの抗がん作用の増大に加えて、ナノダイヤモンドと結合することで、vivoにおける毒性等の副作用も低減しました。
 |
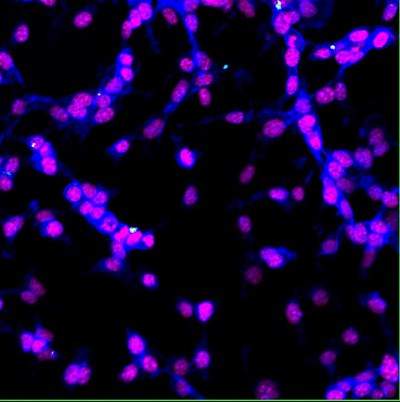 |
| 大腸癌細胞(CT26.WT)が35nmの蛍光ナノダイヤモンド(白色)を細胞内に取り込んでいます。細胞核をDAPI(赤紫色)で染色し、F-アクチンをファロイジン(青色)で染色。多色共焦点解析;共焦点顕微鏡オリンパスFV1000で撮影、固定細胞、40倍、Eva Neuhӧferova氏提供(LaMBI)。 |
|
最適化された薬物送達システムでは、薬剤を除いて投与した際に最小限の毒性しか示さないことが必須であり、このことは多くの薬物送達キャリア候補の制限要因となります。Liら(5)の報告では、ナノダイヤモンドの毒性に関して、無血清培地におけるナノダイヤモンドの影響について述べています。血清タンパク質はナノダイヤモンドと相互作用し、ナノダイヤモンド表面にタンパク質コロナを形成します。ナノダイヤモンド表面に吸着される血清タンパク質量は、37℃で48wt%と高い値を示しました。血清を含む完全培地に分散させたナノダイヤモンドに細胞を曝露すると、ナノダイヤモンドは細胞内コンパートメントに入り込んでも有意な毒性を示しませんでした。しかし、著者らは無血清培地に分散させたナノダイヤモンドの取り込み後、多量の細胞死を確認しました。ナノダイヤモンドに吸着した「保護」作用のあるタンパク質は、無血清培地中のナノダイヤモンド分散を安定化し、凝集体のサイズを小さくします。これは、ナノダイヤモンドを使用して静脈経由で薬物を送達する際の重要な問題となります。
Xiら(6)が報告した注目すべき研究では、神経膠芽腫の治療にナノダイヤモンドを使用することについて考察しています。この治療では、ナノダイヤモンドが、対流強化送達(CED:convection-enhanced delivery)によるドキソルビシンの送達システムとして機能します。CED法は、血液脳関門での薬物透過制限を克服するはずであると想定されています。血液脳関門の存在は、薬物の全身投与後に脳中に効果を発揮できるだけの抗がん剤を蓄積することを妨げることから、膠芽腫の治療における主要な障壁となっています。
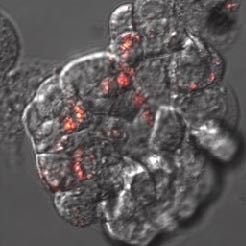 |
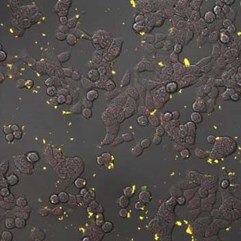 |
蛍光ナノダイヤモンドは、結腸癌細胞HT-29のトランスフェクションをモニターするための細胞内移行プローブとして機能します。A) pH感受性センサーはナノダイヤモンド(赤色)とフルオレセイン(緑色)からなり、フルオレセインは細胞内に取り込まれると信号が減少するが、蛍光ナノダイヤモンドは取り込まれた後も信号が確認できる。B) ナノダイヤモンドを取り込んだHT-29細胞の詳細(赤色)。共焦点顕微鏡オリンパスFV1000で撮影、生細胞、40倍(B -ズーム4倍)、Veronika Benson博士提供(LaMBI)。
遺伝子治療は、がん治療の個別化に向けて大きな期待が寄せられています。この分野では、最適な送達システムがまだ見つかっておらず、ナノマテリアルは有望な技術的アプローチとなっています。Alhaddadら(7)は、ナノダイヤモンドを使用したユーイング肉腫(Ewing sarcoma)細胞へのsiRNA送達を報告しています。in vitro試験では、ポリマーでコーティングされたナノダイヤモンドとEWS-Fli1特異的siRNAの複合体が、タンパク質発現だけでなくEWS-Fli1遺伝子発現の減少を誘発することが示されました。送達機能に次いで、蛍光ナノダイヤモンドは、その固有の発光により担持した薬物を追跡することができます。ナノダイヤモンドの光学特性は、治療薬物や細胞の移動をモニターすることができると同時に、標的細胞とそれらのコンパートメントの相互作用を可視化する等、生物学や医学の発展につながる大きな可能性をもたらします。
今のところ、抗がん剤のデリバリーシステムとしてナノダイヤモンドを使用した臨床試験はありませんが、いくつかの特許が公開されています。1つは特に興味深いもので、この特許研究では、ナノダイヤモンドを薬剤として、具体的にはフリーラジカルを発生させる薬剤をがん治療に使用すると述べています。フリーラジカルは、放射線照射後、ナノダイヤモンドの表面で発生します。ナノダイヤモンドと放射線増感剤を組み合わせると、より効率的にフリーラジカルが発生しました(8)。
まとめると、標的細胞と新規のナノ特異的相互作用を行うナノダイヤモンドキャリアは、生体適合性が高く、治療効果と治療の安全性を高めるドラッグデリバリーの新しい戦略となります。
参考文献
- M E Davis, et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature. 2010 Apr 15;464(7291):1067-70.
- D Passeri, et al. Biomedical Applications of Nanodiamonds: An Overview. J Nanosci Nanotechnol. 2015 Feb;15(2):972-88.
- B Guan, et al. Nanodiamond as the pH-responsive vehicle for an anticancer drug. Small. 2010 Jul 19;6(14):1514-9.
- E K Chow, et al. Nanodiamond therapeutic delivery agents mediate enhanced chemoresistant tumor treatment. Sci Transl Med. 2011 Mar 9;3(73):73ra21.
- J Li, et al. Nanodiamonds as intracellular transporters of chemotherapeutic drug. Biomaterials. 2010 Nov;31(32):8410-8.
- G Xi, et al. Convection-enhanced delivery of nanodiamond drug delivery platforms for intracranial tumor treatment. Nanomedicine. 2014 Feb;10(2):381-91.
- A Alhaddad, et al. Influence of the internalization pathway on the efficacy of siRNA delivery by cationic fluorescent nanodiamonds in the Ewing sarcoma cell model. PLoS One. 2012;7(12):e52207.
- Petit et al. 2014; FR 2993180 A1 20140117, WO 2014009930, A1 20140116.
関連するリンク
Nanodiamonds to treat cancer(report)
Nanodiamonds and Dental Fillings(Forbes article)
著者について
 |
Veronika Benson博士は、生物医学の分野で博士号を取得し、キャリアの大半の期間、がんの診断や治療に使用される新規のアプローチの開発に取り組んできました。著者のプロジェクトは、がん生物学や免疫学の基礎研究、特に薬物によるシグナル伝達経路の変化や遺伝子発現制御に特化しています。現在は、チェコ科学アカデミーで他分野に跨る共同研究チームを率いています。彼女の分子生物学・免疫学研究室(Laboratory of Molecular Biology and Immunology:LaMBI)は、目下、がん、糖尿病、神経変性疾患等のヒト疾患の治療において新たなアプローチとなるナノダイヤモンドシステムの開発に注力しています。 |

