ゲスト寄稿 | 透明化標本の抗体染色のコツ
透明化標本組織を抗体で染色する時のコツを解説します。
Ashley Juavinett著
1914年には既に、光散乱分子の除去による組織の研究の実現を目標とした、臓器組織の「透明化」を試みた記録が残っています。これらの初期のアプローチの多くは今日でも使用されていますが(H Steinke et al., 2001)、近年、この透明化プロセスを、内在性蛍光タンパク質、in situハイブリダイゼーション、免疫組織化学等の現代的技術に適した方法で実現しようと、研究者らはこの100年来の問題に回帰しています。
2013年、Karl Deisseroth博士と彼のチームは、脳を完全に透明化するための高度な技術を実証して反響を呼び起こし、その延長線上で、他の臓器の透明化も行いました(Chung et al., 2013)(この論文を解説した動画はYou Tubeで視聴できます:Nature Video)。この新たな開発によって、ミクロトームの前で夏休みを過ごす数え切れないほどの学部生が救われるだけでなく、同じ組織の免疫染色を繰り返し行って、連続した長距離の脳内ネットワークを可視化できるようになることが期待されます。
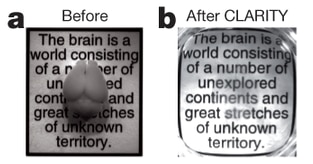
「ハイドロゲル包埋法(CLARITY)」のパワフルな効果を実証(Chung et al., 2013)。
その後、PACT(Passive Clarity Technique)として知られる別の方法が発表され、それ以来、脳組織透明化の競合法となっています(Yang et al., 2014)。実際、多くの異なる方法が過去5年間に発表されており、それぞれに長所と短所があります(下記の表参照)。これらの技術の中には侵襲的な(組織の透明化に電気泳動または他の何らかの方法を必要とする)手法もありますが、ほとんどは、組織を単に複数回溶液に浸して効果的に脂質を除去する、条件の穏やかな方法です。
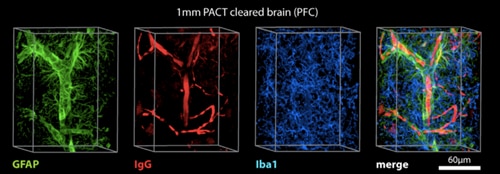
PACT透明化法により、様々な汎用組織学マーカーで標識できるようになります(Yang et al., 2014)。
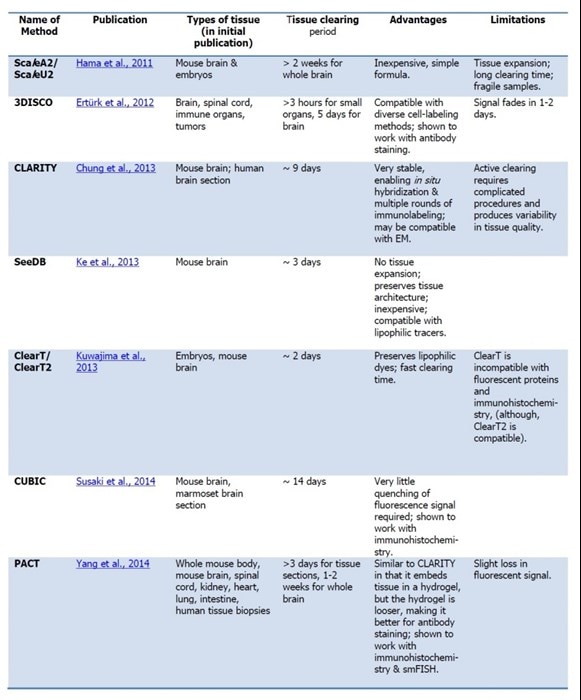
表1:最近の光学的透明化技術のまとめ
(論文へのリンクは記事の末尾に記載しています)
透明化した組織の染色のヒント
こうした技術が開発されて以来、様々な研究室が、透明化組織の免疫染色に成功しており、この技術がとても有効な方法であることを示唆しています(Chung et al, 2013、Zhang et al., 2014)。しかし、最初の「ハイドロゲル包埋法(CLARITY)」の報告以上に、標識を複数回繰り返すことの可能性については、あまり語られていません。これらの方法を利用している数名の研究者*にインタビューし、透明化後の免疫染色についてのヒントをいくつか収集しました。
-
透明化した組織塊の免疫染色は、脳切片の免疫染色よりも時間がかかります。PACTのプロトコールに従うと、組織の種類と大きさにもよりますが、ほとんどの免疫染色に約7~12日かかります(以下に詳述します)。CLARITY法を用いたある研究では、1mmの組織ブロックについて、一次抗体と二次抗体それぞれ1日で実施できると述べています(Zhang et al., 2014、しかし、この論文では比較的薄い組織サンプルを使用していることに留意してください。CLARITY法に関する元の論文では、一次抗体と二次抗体それぞれ2週間とされています)。しかし、ほとんどの研究では、所要時間の下限が報告されており、一般的には、時間をかけるほど良好な結果が得られるという点に留意してください。2mmの脳組織の塊の場合、当研究室では通常2週間かけて染色します。
-
抗体溶液はできる限り交換します。説明書/論文で指定された回数よりも多い回数の方が良いでしょう。インキュベーション時間が長い場合、こうすることで組織の標識に必要な時間を短縮できます!
-
可能な限り小さなフラグメントを使用してください(二次抗体の場合)。二次抗体については、F(ab')2やIgG全体ではなく、Fabフラグメントの方が効果的です。抗体(フラグメント)が小さいほど、組織に浸透しやすくなります。
-
組織切片に対して通常使用するよりも高濃度の抗体溶液を使用してみてください。当研究室では、~約2mmの脳組織の塊に対して希釈倍率(1:200)を推奨していますが、自身のサンプルに最適な濃度を確かめる実験をする必要があります。希釈倍率の異なる抗体溶液を同じインキュベーション時間で反応させて抗体価測定実験を行い、実験に最適な希釈倍率を決定すると良いでしょう。
抗体価測定実験の参考資料:Antibody dilutions and titer(abcam.com) -
可能であれば、厚さが数百ミクロン未満になるよう組織を小さくスライスしてください。抗体が通過しなければならない組織が少ないほど、良好な結果が得られます。組織周辺部の染色が濃くなってしまっても許容できる場合、問題はないでしょう。
-
私たちの経験では、PACT法はCLARITY法よりも免疫染色で良好な結果が得られました。PACTマトリックスは若干緩い状態なので(ハイドロゲル中に組織を包埋しないため)、抗体が浸透できるスペースが多くなります。つまり、PACTと組み合わせて免疫染色を行った方が効率的なのではないでしょうか。当研究室では、他の透明化法を用いた免疫染色はまだ試したことがありません。
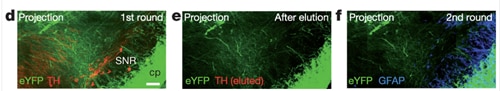
Chungらは最初に発表した論文で、同じ脳組織で複数回の免疫染色(THを観察後にGFAPを観察)を行っています(Chung et al., 2013)。
一般的には、最適な染色画像が得られるまで、組織のサイズ、インキュベーション時間、透明化の手法、抗体の濃度等を変更していく方法が最も良いでしょう。
組織透明化と抗体標識を併用して実施した経験はありますか?特にプロテインテックの製品を使用した体験談があれば、ぜひお聞かせください!
*本記事を執筆するにあたり、お世話になったCallaway研究室(https://callaway.salk.edu/)のEsther Richler博士およびラボメンバーの皆様のアドバイスと造詣に感謝します。
表1の参考文献
Hama et al., Nat Neurosci. 2011 Aug 30;14(11):1481-8.
Ertürk et al., Nature Protocols. 2012; 7(11):1983-95.
Chung et al., Nature. 2013 16;497(7449):332-7.
Ke et al., Nature Neurosci. 2013; 16(8):1154-612013.
Kuwajima et al., Development. 2013; 140(6):1364-8.
Susaki et al., Cell. 2014, 24;157(3):726-39.
Yang et al., Cell. 2014, 14;158(4):945-58.
ゲストブロガーのプロフィール
| Ashley Juavinett氏は、UCSD(University of California, San Diego)の神経科学博士課程に在籍する、NSF(National Science Foundation)のGraduate Research Fellowである、科学ライターを目指す学生です。Salk Institute(カリフォルニア州ラホーヤ)で、in vivoイメージング装置を用いて、マウスの視覚認知に関係する神経回路を研究しています。共同科学ライティンググループ「NeuWrite San Diego」(https://www.neuwriteSD.org)の共同運営メンバーを歴任し、自身のブログ(https://scramblingforsignificance.blogspot.com)では神経科学や社会のトレンドについて執筆を行っています。 |  |

