細胞を並べて流路に乗せる―フローサイトメトリー技術を最大限に活用しましょう
フローサイトメトリー技術を活用できるアプリケーション、解析データの見方、結果の解釈や読み方等を含む基礎的・応用的内容を紹介します。
目次
はじめに
フローサイトメトリー(FC:Flow cytometry)は、免疫学、分子生物学、微生物学、がんや感染症の研究等において様々な用途に用いることのできる、レーザー光を使用する技術です。フローサイトメトリーでは、一列に並べられて流路系を通過していく単一の細胞に対して、レーザーを照射することで1つ1つの細胞を解析します。レーザーを細胞に照射して得られる散乱光や蛍光を検出し、迅速に細胞のサイズや顆粒密度(Granularity:細胞内部構造の複雑さ)等の情報を得ることができます。現在までに様々な種類の蛍光色素、蛍光タンパク質、タンデム蛍光色素、ポリマー色素が販売されるようになったことに加え、最大5つのレーザーを搭載する高性能なフローサイトメーターの登場によって、30種類以上のパラメーターからなるパネルを設計・構築できるようになっています。
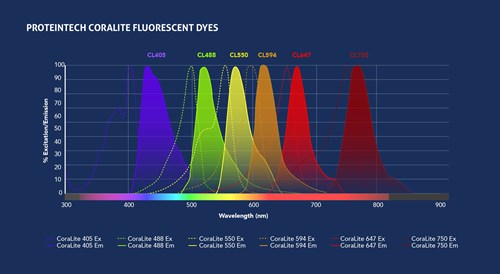
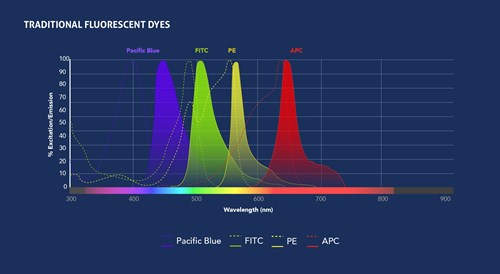
図1. プロテインテックのCoraLite®蛍光色素(上段)と、一般的に使用されている蛍光色素(下段)の励起波長および蛍光波長。パネルの構築には、Spectra Viewerを利用できます。
データの解析
一般的に、フローサイトメトリーで得られるデータの解析方法は、大きく3種類に分けることができます。
1. 前方散乱光(FSC)・側方散乱光(SSC)
フローサイトメトリーでは、細胞に照射されたレーザーの散乱光を解析することで、細胞のサイズや細胞内の複雑性に関する情報を取得することができます。「前方散乱光(FSC:Forward scatter)」および「側方散乱光(SSC:Side scatter)」は、それぞれ細胞のサイズまたは細胞内の複雑性を示すパラメーターであり、死細胞やダブレット(流路を通過する際に誤って1つの細胞として認識されてしまった2つの細胞)のような解析に不要な細胞を除外(ゲートアウト)するためにも利用されます。存在する細胞種があらかじめ判明しているサンプル(例:血液、脾臓、骨髄等)の場合、FSC/SSCのデータから単球、リンパ球、顆粒球等の特定の種類の細胞を識別することが可能です。
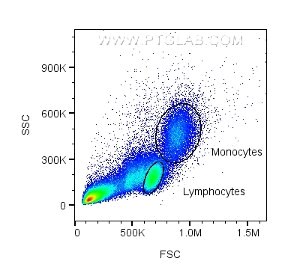
図2. 細胞のサイズ・granularityに基づき、単球・リンパ球をゲーティングしたFSC/SSCプロット。
2. 密度プロット
二変量散布図としても知られる密度プロットは、2種類の蛍光色素/マーカーを同時にグラフ化します。グラフ上にプロットされたそれぞれのシングルドットは、個々の細胞(またはイベント)を表し、ヒートマップとして表現される色の違いは、細胞(またはイベント)の密度を表します。その際、黄色/赤色は高密度、青色/緑色は低密度を意味します。ドットの分布や色を参考にすることで、サブ集団の明瞭な視覚化および分画が可能になります。密度プロットでは、マーカーの発現を基にグラフエリアを二重陽性(右上)、二重陰性(左下)、マーカー1(X軸)陽性・マーカー2(Y軸)陰性(右下)、マーカー1(X軸)陰性・マーカー2(Y軸)陽性(左上)の4つに区分し、4分割線を設定します。具体例は図3をご覧ください。
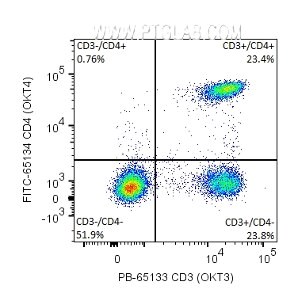
図3. ヒト末梢血単核細胞(PBMC:peripheral blood mononuclear cell)のフローサイトメトリー:1x10^6個のPBMC細胞の細胞膜表面をPB標識ヒトCD3抗体(カタログ番号:PB-65133、クローン番号:OKT3、5μl、後継品はAB-65133を参照してください)、FITC標識ヒトCD4抗体(カタログ番号:FITC-65134、クローン番号:OKT4、5μl)で染色した。細胞:固定処理なし。リンパ球領域をゲーティングした。
3. ヒストグラム
ヒストグラムでは、細胞の単一の蛍光パラメーターに基づきグラフ化します。ヒストグラムは、2つのピーク(陰性および陽性)を重ねて表現され、ゲーティングや電圧の調整をする場合等、機器の条件を設定する際にも用いられます。理想的には、電圧を特定の波長範囲において陰性集団と陽性集団を最も分離できるような値に調整します(具体例は図4をご覧ください)。
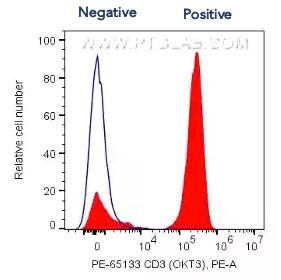
図4. PBMCのフローサイトメトリー:1x10^6個のPBMC細胞の細胞膜表面をPE標識ヒトCD3抗体(カタログ番号:PE-65133、クローン番号:OKT3、5μl、赤)、またはマウスIgG2aアイソタイプコントロール抗体(青)を使用して染色した。細胞:固定処理なし。リンパ球領域をゲーティングした。
フローサイトメトリー技術を応用して実施される、主なアプリケーション例を以下にまとめました。
イムノフェノタイピング(免疫表現型解析)
イムノフェノタイピング(免疫表現型解析)は、フローサイトメトリー技術で最も一般的な応用例です。イムノフェノタイピングでは、血液、骨髄や、リンパ節、脾臓、腫瘍等のあらゆる組織を単一細胞懸濁液に調製したサンプルの免疫プロファイルを一斉に測定することができます。現在では、免疫細胞マーカーが詳細に特性解析されており、免疫学や免疫腫瘍学の分野への適用が著しく拡大しています。抗体とフローサイトメーターは、それぞれに高感度な試薬と装置であり、その組み合わせによって非常に稀な細胞集団の検出を実現することができます。
プロテインテックの関連製品:フローサイトメトリー用標識抗体
図5は、単離したヒトPBMCのイムノフェノタイピングの一例です。イムノフェノタイピングによって、患者血液中の免疫細胞集団の割合を示すことができます。得られる情報は、免疫反応や特定の種類の細胞の変化を反映している可能性があり、疾病のメカニズム解明や治療効果の示唆に寄与します。得られたデータから特定の免疫細胞の比率を求め、健常人で得られる値や、治療等の処置群の値と比較して、その変化や有意差を解析します。
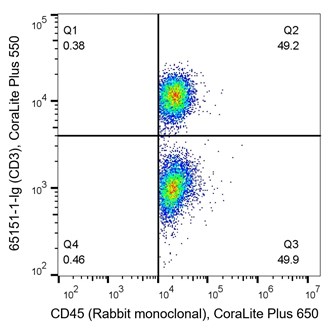
T細胞は適応免疫応答の重要な鍵を担い、イムノフェノタイピングで頻繁に解析される細胞です。CD3は全てのT細胞のマーカーで、CD4はヘルパーT細胞特異的マーカー、CD8は細胞傷害性T細胞特異的マーカーです。T細胞は造血幹細胞(HSC:Hematopoietic stem cell)に由来する細胞であり、CD45マーカー(造血系細胞マーカー)も表出しています。図5に示した密度プロットは、T細胞のイムノフェノタイピングの一例です。左のパネルは、CD45(X軸、造血系細胞マーカー)、CD3(Y軸、T細胞マーカー)を使用して、PBMCを共染色しています。Q2はCD45+/CD3+の両方のマーカーを共に発現している細胞を表し、Q2の細胞群がT細胞に該当します。Q3はCD45+/CD3-の細胞を表し、Q3の細胞群はT細胞以外の造血系細胞の集団に該当します。図5における左のパネルの解析結果では、データはサンプルのおよそ半数がT細胞であることを示しています(Q2:49.2%)。右のパネルは、CD3とCD4を使用して細胞を共染色しています。このパネルの密度プロットは、33.1%の細胞がヘルパーT細胞であり(CD3+/CD4+)(Q14)、20.6%の細胞がCD3を表出しているヘルパーT細胞以外のサブタイプのT細胞であることを示しています(Q13)。CD3-/CD4-(Q16)の細胞は、サンプル中のその他の免疫細胞と考えられる細胞を表しています。
 |
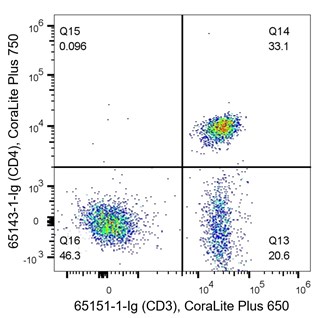 |
図5. PBMCのフローサイトメトリー解析
(左図)1x10^6個のPBMC細胞をFlexAble CoraLite® Plus 647 Kit(カタログ番号:KFA003)で標識したCD45抗体、FlexAble CoraLite® Plus 555 Kit(カタログ番号:KFA022)で標識したCD3抗体(カタログ番号:65151-1-Ig、クローン番号:UCHT1)を使用して共染色した。
(右図)1x10^6個のPBMC細胞をFlexAble CoraLite® Plus 647 Kit(カタログ番号:KFA023)で標識したCD3抗体(カタログ番号:65151-1-Ig、クローン番号:UCHT1)、FlexAble CoraLite® Plus 750 Kit(カタログ番号:KFA024)で標識したCD4抗体(カタログ番号:65143-1-Ig、クローン番号:RPA-T4)を使用して共染色した。
セルソーティング(Cell Sorting)
セルソーティングとは、蛍光マーカーを使用して細胞集団を単離/分取する手法です。セルソーティングは、FACS(Fluorescent Activated Cell Sorting)という名称でも知られています。セルソーティングには、血液中の血中循環がん細胞(CTC:Circulating tumor cell)の単離(フローサイトメトリー用のCTCマーカーの一覧表はこちら)や、蛍光色素や蛍光タンパク質発現ベクターをトランスフェクションした細胞の選抜、特定の免疫細胞集団の単離・分取等の利用用途が含まれます。ソーティングした細胞の下流のアプリケーションには、ソーティング細胞の培養、RNAシーケンス、プロテオミクス解析、代謝物解析等が挙げられます。
細胞周期解析(Cell Proliferation Assay)
細胞周期解析は、フローサイトメトリーのアプリケーションの中でも最も初期の応用例の1つです。細胞周期解析では、細胞周期の各段階と相関してDNAと化学量論的に結合する蛍光標識DNAプローブ(細胞あたりのDNA総量に比例して結合します)を使用します。多くの場合、ヨウ化プロピジウム(PI:Propidium iodide)やDAPI(4',6-diamidino-2-phenylindole)が細胞周期解析に使用されます。細胞周期解析は、均一な細胞集団(例:不死化細胞株)を使用して薬剤の作用を評価する場合等に一般的に使用されます。
細胞増殖アッセイ
フローサイトメトリーを使用して細胞増殖を測定する方法は多数あります。例えば、複製DNAにチミジンアナログ(BrdU・EdU)を取り込ませる方法が挙げられます。最長で6時間、細胞をチミジンアナログで処理した後、固定・透過処理を行い、DNAに取込まれたチミジンアナログ塩基対を染色します。その他の方法としては、CFSE(Carboxyfluorescein succinimidyl ester)等の蛍光色素を利用する方法が挙げられます。CFSEは細胞膜を透過した後エステラーゼの作用を受けてエステル化し、細胞内構造(例:リジン残基)に共有結合して安定的に蛍光を観察できる色素です。細胞の複製後、CFSEは約半量が娘細胞に受け継がれます。CFSEを用いる方法の場合、数世代にわたってその増殖の様子を追跡することができます。他にも、Ki67やPCNA等の細胞増殖に関与する抗原の発現を測定することで、細胞の増殖を定量化することができます。
細胞生存率アッセイ(Cell Viability Assay)
細胞生存率アッセイは、生細胞のみをゲーティングして解析できているか確認するために、多くの場合、イムノフェノタイピング等の他のフローサイトメトリーアプリケーションと併用される測定方法です。細胞周期の解析に用いられるDNA結合色素を細胞生存率測定に用いることもできますが、その場合の対象サンプルは固定されていない細胞に限定されます。プロテインテックのPhantom Dyeのようなアミン結合型生存率測定用色素は、固定サンプルの生存率評価にも使用することができます。Phantom Dye等の色素は、死細胞の構造破綻した細胞膜を透過し、細胞内のタンパク質のアミン基に結合します。その結果、死細胞では蛍光色素の測定値が著しく高くなることから、細胞の生死を容易に識別することができます。使用するサンプルに適した生存率測定用色素の選択方法に関する詳細は、生存率測定色素をテーマにしたプロテインテックのブログをご覧ください。
細胞死
細胞は、ネクローシス(Necrosis)等の非制御的な細胞死、またはアポトーシス(Apoptosis)やネクロプトーシス(Necroptosis、ネクロトーシス)、パイロトーシス(Pyroptosis)、フェロトーシス(Ferroptosis)等のプログラム細胞死のいずれかによる、特定の経路を介して死滅します。
プロテインテックの参考ブログ:ネクローシス(Necrosis)とアポトーシス(Apoptosis)の違いは?
アポトーシスは、フローサイトメトリー技術を利用して、幅広く研究されています。アポトーシスの研究には、アポトーシスの際に細胞膜の外側に露出するホスファチジルセリン(PS:phosphatidyl serine)に結合する、Annexin V等のマーカーがよく使用されます。その他に、TUNEL(TdT-mediated dUTP Nick End Labeling)アッセイも一般的にアポトーシス検出に利用されており、TUNELアッセイでは蛍光色素を標識したデオキシウリジン三リン酸(dUTP)を使用します(TUNELアッセイキット)。アポトーシスの際に生じるDNAフラグメントの3’-OH末端に、TdT(terminal deoxynucleotidyl transferase)の作用によって蛍光標識dUTPを付加させることで、断片化DNAを検出します。また、アポトーシスのシグナル伝達には、カスパーゼ3(caspase 3)が必要とされるため、その発現量や活性をアポトーシスの評価に利用して、その他の細胞死とアポトーシスを区別することもできます。
図6に示したTUNELアッセイの密度プロットでは、パネルの左から右へと、アポトーシス細胞の割合が増加しています。赤の枠線(P3)は、CoraLite®594蛍光色素標識dUTPが励起して観測される蛍光の閾値を表します。細胞がアポトーシスを開始して断片化DNAが生じると、dUTPが結合・蓄積し、閾値を超えた領域(P3)に蛍光が観察されるようになります。このようなアポトーシスイベントは、蛍光強度として密度プロットのグラフで示されます。
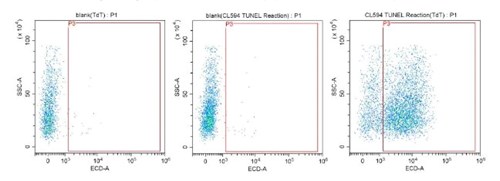
図6. CoraLite®594 TUNEL Assay Apoptosis Detection Kit(カタログ番号:PF00009)を使用したフローサイトメトリー解析:
Jurkat細胞を3日間培養し、フローサイトメトリーを実施した。Jurkat細胞サンプル中のアポトーシス細胞を検出したデータに基づき、密度プロットを作成した。
プロテインテックのCoraLite® Plus 488-Annexin V and PI Apoptosis Kitは、細胞生存率とアポトーシス細胞を同時に評価するために使用できるキットです。本キットを使用すれば、アポトーシス初期の細胞と、アポトーシス後期の細胞を区別することができます。アポトーシスの初期段階にある細胞では、細胞膜の脂質二重層に存在するホスファチジルセリン(PS)が細胞膜表面に露出する一方、細胞膜の完全性は維持されています。そのため、PIが細胞を透過してDNAに結合できないものの、Annexin Vがホスファチジルセリン(PS)と結合します。しかし、ネクローシスが発生した細胞では、細胞膜の構造が破綻しているため、PIが細胞内に浸透しDNAの二重螺旋にインターカレーションします。アポトーシス初期段階の細胞はPI-/Annexin V+、アポトーシス後期段階の細胞は細胞膜が損傷していることからPI+/Annexin V+、ネクローシス細胞はPI+/Annexin V-、生細胞はPI-/Annexin V-を示します(図7のクオドラントリージョン(4分割プロット)参照)。アッセイの詳細についてはプロテインテックのプロトコール解説(フローサイトメトリーサポートページ)をご覧ください。
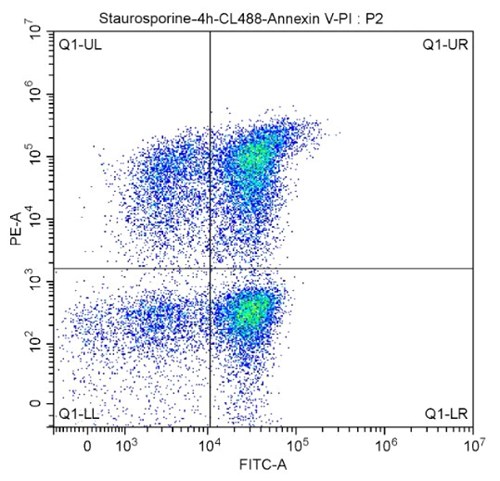
図7. CoraLite®488-Annexin V and PI Apoptosis Kit(カタログ番号:PF00005)を使用したフローサイトメトリー解析。
細胞集団は、SSC/FSCプロットによって解析しました。
X軸:CL488標識Annexin V(グラフではFITC-A)、Y軸:PI(グラフではPE-A)。
プロットの各領域に存在する陽性染色細胞は、次のように解釈します。
Q1-UL(CL488-Annexin V)-/PI+:主にネクローシス細胞(機械的損傷を受けた細胞と共に、わずかにアポトーシス後期細胞が存在する場合があります)
Q1-UR(CL488-Annexin V)+/PI+:アポトーシス後期細胞
Q1-LR(CL488-Annexin V)+/PI-:アポトーシス初期細胞
Q1-LL(CL488-Annexin V)-/PI-:生細胞
通常、アポトーシス率はQ1-UR+Q1-LR(アポトーシス後期細胞群+アポトーシス初期細胞群)を用いて計算されます(AnnexinV陽性群をすべてアポトーシス細胞とみなします)。
ネクロプトーシスは、アポトーシスを阻害する働きを有する病原体感染に対する応答として、感染細胞が用いるプログラム細胞死の代替手段です。ネクロプトーシスは、RIP3やMLKLによる制御性細胞内シグナル伝達機構と、ネクローシスで起こる細胞膜に生じた細孔を介した細胞内成分の漏出機構を併せ持ちます。アポトーシスが免疫学的反応の抑制された細胞死であることとは対照的に、ネクロプトーシスでは炎症反応が促進されます。ネクロプトーシスはカスパーゼ非依存的に機能し、caspase 3-/RIP3+ゲーティングによりフローサイトメトリーで検出することができます。
貪食アッセイ(Phagocytosis Assay)
貪食作用(Phagocytosis)は、pH感受性蛍光色素で標識した細菌を目的の細胞に感染させ、細胞ファゴソーム(食胞)内の酸性環境下で生じる蛍光をフローサイトメトリーで測定することで定量化できます。
細胞内サイトカイン染色(ICS:Intracellular Cytokine Staining)アッセイ
細胞内サイトカイン染色(ICS)アッセイは、免疫細胞活性化に関するex vivo定量法として用いられる手法であり、T細胞の活性化等の指標として測定されます。サイトカインは、分泌型分子のため、はじめに細胞をBrefeldin A等の細胞内タンパク質輸送阻害剤で処理し、サイトカインがゴルジ体を介して分泌されないように阻害することで、細胞内にサイトカインを蓄積させます。その後、細胞をサイトカイン特異的抗体でプローブします。細胞内サイトカイン染色(ICS)アッセイは、免疫モニタリングの実施にあたり複数のパラメーターを設定することが可能で、細胞表面マーカーや産生サイトカインによって細胞の種類を同定することができます。複数のパラメーターを設定できるため、フローサイトメトリー解析に用いる血液サンプル量が少量で済み、患者由来血液等の限られたサンプルを用いる場合に利点となります。細胞内サイトカイン染色(ICS)アッセイは、インターフェロン(例:IFN-γ)等のサイトカイン解析に応用することができます。
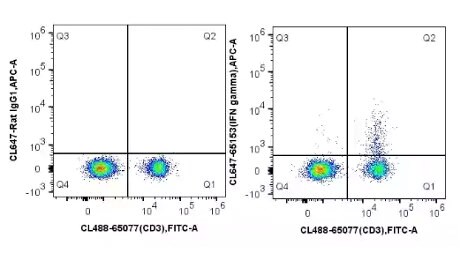
図8. C57BL/6マウス脾臓細胞を使用したICSアッセイのフローサイトメトリー解析:C57BL/6マウス脾臓細胞をタンパク質輸送阻害剤存在下でPMA・Ionomycinを用いて4時間刺激し、CoraLite® Plus 488標識Mouse CD3抗体(カタログ番号:CL488-65077、クローン番号:17A2)で染色後、4% PFAで固定処理し、Flow Cytometry Perm Buffer(カタログ番号:PF00011-C)で透過処理を実施した。その後、CoraLite® Plus 647標識ラットIgG1アイソタイプコントロール抗体(左)、またはCoraLite® Plus 647標識マウスIFN gamma抗体(カタログ番号:CL647-65153、クローン番号:XMG1.2、5μl)(右)で染色した。
細胞内カルシウムフラックス(Intracellular Calcium Flux)
カルシウムイオンは細胞内における中心的なシグナルトランスデューサーであり、カルシウムイオンの恒常性は細胞機能を制御します。カルシウムイオン恒常性の調節不全は、様々な疾病と関連しています。細胞内のカルシウムイオン動態の測定には、特定の蛍光色素とフローサイトメトリー技術の組み合わせを応用することができます。例えば、カルシウムイオンとキレートを形成し、カルシウム濃度の変化に伴い蛍光波長が変化するIndo-1のような蛍光色素を使用して、細胞内カルシウム濃度を定量することができます。
ハイスループットスクリーニング
製薬業界では、CRISPRライブラリーやランダム変異誘発による変異体のハイスループットスクリーニング(HTS:High Throughput Screening)にフローサイトメトリーが使用されています。また、酵母や細菌を対象とした細胞表面ディスプレイシステムを使用することによって、フローサイトメトリーで酵素や抗体ライブラリーのスクリーニングを実施することもできます。目的の組換え体のサブ集団をソーティング(選別)すると共に複数のパラメーターの解析を同時に実施できるという特長は、その他のスクリーニング法よりも優れたフローサイトメトリーの大きな利点です。
フローサイトメトリーに関する詳細情報はフローサイトメトリーのサポートページをご覧ください。
Lucie Reboud著(マンチェスター大学博士課程在籍、プロテインテック インターン生)
参考文献
K M McKinnon. Flow Cytometry: An Overview. Curr Protoc Immunol. 2018 Feb 21;120:5.1.1-5.1.11.