パーキンソン病のバイオマーカーアッセイ法の検証
α-シヌクレインのシード増幅アッセイ(SSA:seed amplification assay)によってパーキンソン病罹患者を高い信頼性で特定できることを示した臨床研究を紹介します。
Jessica Lacoste博士著(トロント大学、博士研究員)
パーキンソン病(PD:Parkinson’s disease)は、ふるえ(振戦)、こわばり(筋強剛)、バランス維持の困難、協調運動の困難等の、意図しない動きや制御不能な動きを引き起こす脳疾患です。神経変性疾患の中でも、パーキンソン病は、アルツハイマー病に次いで2番目に罹患者が多い疾患であり、65歳以上の2~3%が罹患しています。
パーキンソン病におけるレビー小体形成のメカニズムと病態生理
パーキンソン病に特徴的な病理学的所見の1つに、神経細胞内へのα-シヌクレインタンパク質(α-synuclein)の凝集と蓄積が挙げられます(1)。正常な神経細胞におけるα-シヌクレインタンパク質の機能は完全には解明されていません。しかし、可溶性のα-シヌクレインのモノマー体(単量体)がオリゴマー(多量体/重合体)化し、凝集することによりレビー小体(神経細胞に認められる封入体構造、LB:Lewy body)が生じると共に、神経毒性を示すようになることが知られています(1)。
α-シヌクレインの凝集によるレビー小体の形成プロセス
-
α-シヌクレインのモノマー体(単量体)が重合し、オリゴマー(多量体/重合体)を形成します。
-
オリゴマー同士が結合し、比較的分子量の小さな高分子オリゴマーであるプロトフィブリル(Protofibril、フィブリル(fibril、線維)の前段階の物質)を形成します。
-
プロトフィブリルは、分子量の大きな不溶性α-シヌクレインフィブリルを形成します。この線維がレビー小体と呼ばれる凝集体となります(1)
α-シヌクレインの蓄積と凝集の根底にある引き金となる原因として、タンパク質の過剰産生、タンパク質のミスフォールディングやオリゴマー化が生じやすくなる遺伝子変異、ネイティブ型のα-シヌクレインまたはミスフォールディングα-シヌクレインを分解する機構の欠陥等が挙げられます(1)。
パーキンソン病のバイオマーカー
パーキンソン病に特異的かつ感度の高いバイオマーカーの同定は、数十年間にわたって重要かつ最先端の研究課題として位置付けられています。精度の高いバイオマーカーは、疾患のリスクや進行の評価、早期診断の推進に貢献します。現在、臨床的なパーキンソン病の診断を確定するために広く許容されている唯一の手法は、患者の脳組織の病理解剖(剖検)による解析手法です。そのため、パーキンソン病の研究と患者の治療の両面において、有効なバイオマーカーの開発が強く望まれており、現在臨床研究が進められています。
近年、「シード増幅アッセイ/シード増幅分析(SAA:seed amplification assay)」法と呼ばれるin vitroでタンパク質凝集体の形成速度を観察する手法が、脳脊髄液(CSF:cerebrospinal fluid)サンプルを対象としたα-シヌクレイン凝集体の検出にも応用されています。実際にα-シヌクレインシード増幅アッセイ(αSyn-SAA)は、高い感度と特異度でパーキンソン病患者と対照群の健常人を識別できることが臨床研究によって示されました(2、3)。
シード増幅アッセイ(SAA:Seed Amplification Assay)
In vitroにおけるタンパク質ミスフォールディング現象および凝集体形成は、in vitro中に凝集タンパク質(シード:線維原物質)が生じたり添加されたりすることによって、反応系に存在するネイティブ型タンパク質のコンホメーションの変化が誘発・促進されることで生じます。これは重合核形成メカニズム(Seeding nucleation mechanism)として説明されます(図1参照)(4)。最終的に凝集体は会合し、難分解性の不溶性線維(アミロイドフィブリル、アミロイド線維)を形成します(5)。
シード増幅アッセイ(SAA)では、ネイティブ型構造のα-シヌクレイン組換えタンパク質を含む溶液に、被験者由来の脳脊髄液(CSF)を添加します。被験者がパーキンソン病に罹患している場合、脳脊髄液(CSF)サンプルにはin vitroの反応系で「シード」として機能する、タンパク質凝集誘発性のα-シヌクレインの凝集体が含まれていると考えられます。その後、断片化(Fragmentation)と伸長(Elongation)のサイクルによって、α-シヌクレインの凝集は促進されます(図1)。断片化サイクルでは凝集能を有するシード数が増加します。また伸長サイクルではネイティブ型構造のα-シヌクレイン組換えタンパク質が凝集体に変換されます。この断片化と伸長のプロセスを数サイクル繰り返すことで凝集タンパク質が増幅し、凝集タンパク質が会合することでα-シヌクレインフィブリルが形成されます。α-シヌクレインフィブリルは、蛍光色素であるチオフラビンT(ThT:Thioflavin T)等によって可視化・定量されます。チオフラビンT(ThT)は、アミロイドフィブリルに結合すると強い蛍光を発する小分子です(6)。
シード増幅アッセイ(SAA)におけるタンパク質凝集体の形成過程には、協調し順序立てて進行する3つの段階があります(図1)。
-
遅滞期(Lag phase、核形成期):凝集プロセスの初期段階である遅滞期では、シード(凝集体)形成に至る初期のタンパク質ミスフォールディングが生じます。そのため、観察可能な凝集体の形成は生じません。
-
伸長期(Elongation phase、成長期):十分な量のシードが形成されると、プロトフィブリルとフィブリルの形成が急速に進行し、その結果、観察可能な凝集体の数が増加します。
-
定常期(Stationary phase):基質(α-シヌクレイン組換えタンパク質)が枯渇し、凝集体形成速度が遅くなるため、凝集体形成に変化が認められなくなり、反応溶液は平衡状態に達します。
パーキンソン患者由来の脳脊髄液(CSF)中に含まれるα-シヌクレインタンパク質凝集体(シード)が反応溶液に添加された場合、シード形成に要する最初の段階が省略されるため、遅滞期(Lag phase)は著しく短縮されます。そのため、予めシードが存在していたサンプルでは凝集体は迅速に検出されます。
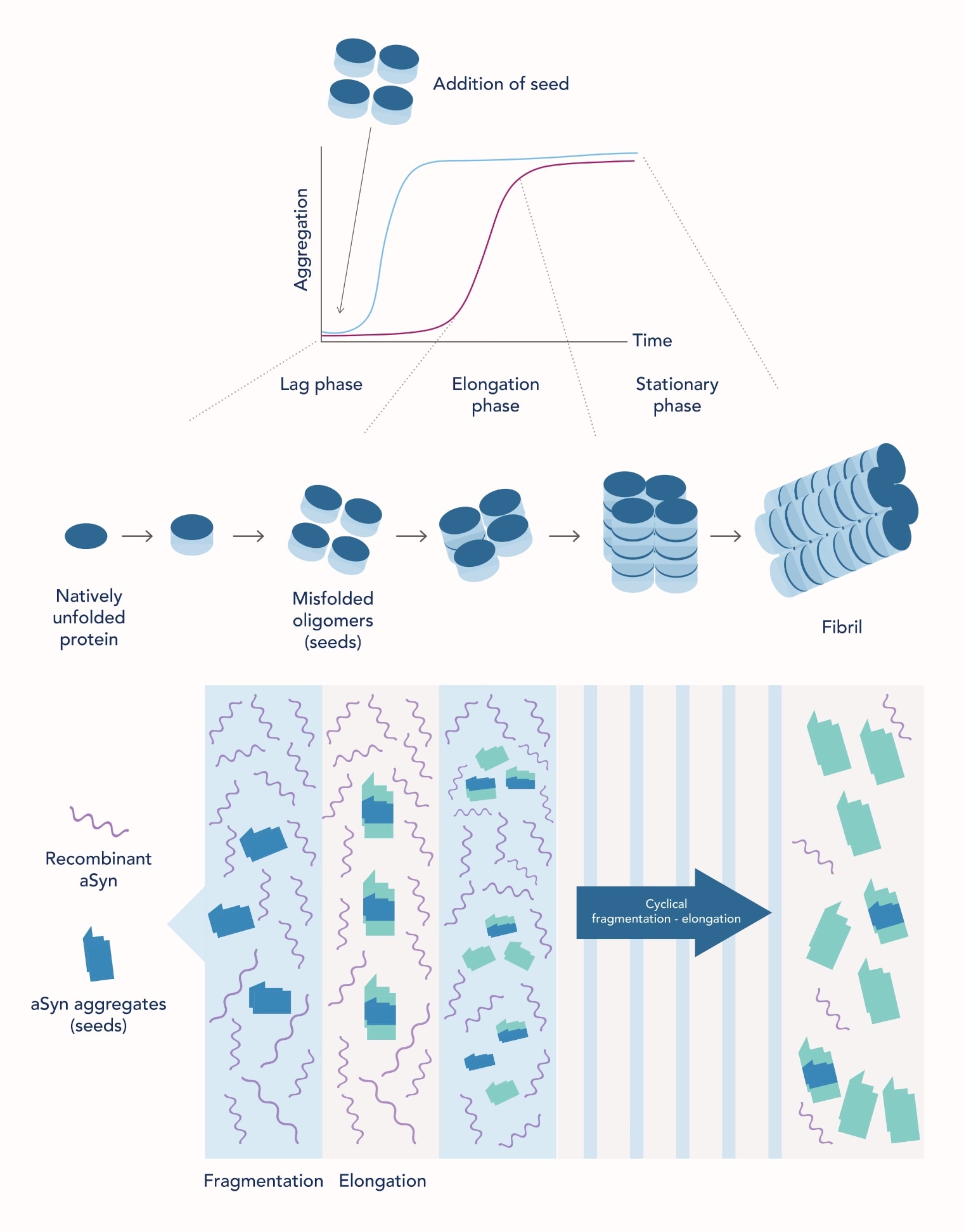
図1. 上段:タンパク質ミスフォールディングと凝集体形成のシード(Seed)/重合核形成モデルの模式図。
下段:シード増幅アッセイ(SAA)反応の模式図(引用元:参考文献4)
パーキンソン病診断におけるα-シヌクレインシード増幅アッセイ(αSyn-SAA)の極めて重要な役割
過去に実施されたα-シヌクレインシード増幅アッセイ(αSyn-SAA)の評価のための臨床試験では、被験者数が少人数であったため、得られた結果は確証に乏しいものでした。2023年にLancet誌に掲載された研究は、過去の臨床試験の規模を拡大して、様々な種類・病期のパーキンソン病患者が含まれる多施設コホート試験の参加者に対し、α-シヌクレインシード増幅アッセイ(αSyn-SAA)法を使用した分子特性評価を実施しました(7)。この研究では、遺伝子変異型や症状の異なるパーキンソン病患者を対象にα-シヌクレインシード増幅アッセイ(αSyn-SAA)の性能を評価し、収集したデータを使用してパーキンソン病発症リスクの高い群における病態生理学的変化の初期の徴候を特定しました。
この研究は、既に十分な特性解析が実施されている、多施設共同試験であるParkinson's Progression Markers Initiative(PPMI)コホート研究の参加者を対象に実施されました。このコホート研究には、パーキンソン病関連遺伝子の変異を有する患者、遺伝子変異のない患者、健常対照者、パーキンソン病発症リスクを有する者(パーキンソン病前駆症状を有する者、またはパーキンソン病と診断されていないものの関連遺伝子変異を有する保因者)が含まれています。この研究では、163名の健常対照者と、パーキンソン病患者、パーキンソン病発症リスクを有する者の合計1,123名の参加者が登録されました。
アッセイの「感度*1(sensitivity)」は高く、パーキンソン患者全体の87.7%がα-シヌクレインシード増幅アッセイ(αSyn-SAA)で陽性と判定されました。また、健常対照者を対象としたアッセイの「特異度*2(specificity)」は96.3%でした。この結果は、α-シヌクレインシード増幅アッセイ(αSyn-SAA)は高い精度でパーキンソン病患者と健常対照者を識別することを示しています。臨床的特徴のうち嗅覚減退(嗅覚の低下)の症状を有するパーキンソン病患者に対する感度は97.2%を示しました。そのため嗅覚減退の症状は、α-シヌクレインシード増幅アッセイ(αSyn-SAA)による陽性判定の最も堅牢な予測因子であることが示唆されました。
この研究では、遺伝子変異を有するサブグループ間の感度に変動が認められ、特にLRRK2変異を有するパーキンソン病患者の感度が低くなりました。α-シヌクレインシード増幅アッセイ(αSyn-SAA)の感度は、GBA N409S遺伝子変異患者が最も高く(95.9%)、次いで孤発性患者の感度が高く(93.3%)、LRRK2 G2019S遺伝子変異患者の感度が最も低くなりました(67.5%)。310名のパーキンソン病と診断されていない関連遺伝子変異の保因者のうち、25名(8%)のみがアッセイで陽性と判定されました(LRRK2変異保因者:9%、GBA変異保因者:7%)。
研究成果が将来的に果たす役割:本研究により得られた成果は、医師が患者のパーキンソン病を客観的に定義することに寄与する可能性があります。この検証されたアッセイにより、早期診断、α-シヌクレインをターゲットにした治療法開発時の患者の選定や臨床試験計画時の高リスク患者の特定、疾患予防のためのより効果的な戦略の構築につながることが期待されます。
*1、*2:臨床試験では「感度(sensitivity)」および「特異度(specificity)」という尺度を使用して、バイオマーカーアッセイの性能を評価します。感度とは、疾患を有する者を陽性と判定するアッセイの能力を指します。特異度とは、疾患を有さない者を陰性と判定する能力のことです。
参考文献
1. W Poewe, et al. Parkinson disease. Nat Rev Dis Primers. 2017 Mar 23:3:17013.

