タンパク質精製用タグ
一般的に利用されるタンパク質精製用アフィニティタグの概要
アフィニティタグは、タンパク質精製のための非常に有用なツールです。アフィニティタグを目的タンパク質に融合し、タグ特異的に結合する樹脂担体を使用することで、タンパク質精製プロセスを合理的に実施することができます。精製用タグはタンパク質の発現量、溶解性、正確なフォールディング、タンパク質分解からの保護、発現タンパク質の細胞内輸送等に影響を及ぼすため、タグの選択は重要なステップとなります。また、精製用タグの選択によって、使用するアフィニティ樹脂担体の種類が決定します。
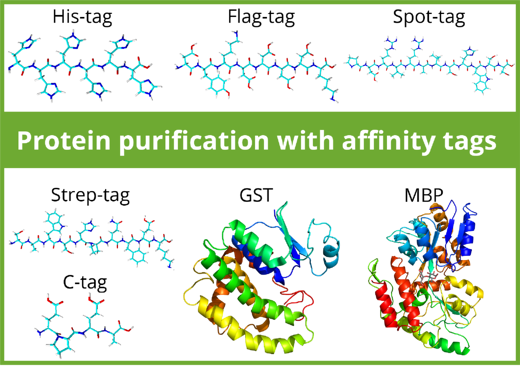
精製用タグは「ペプチドタグ」と「タンパク質タグ」の2種類に分類できます。ほとんどのペプチドタグは生化学的に不活性であり、通常はタンパク質フォールディングや溶解性に影響を及ぼさず、タンパク質機能に干渉することはありません。その一方、MBP(Maltose Binding Protein)タグやGST(Glutathione-S-Transferase)タグ等のタンパク質タグは、タンパク質の溶解性を高め、正確なフォールディングを促進します。精製後に実施するアプリケーションによっては、精製ステップ後にタンパク質タグを切断して取り除く場合があります。ペプチドタグは多くの場合で目的タンパク質に付加させたまま使用されます。
使用するアフィニティタグと樹脂担体は、精製タンパク質の純度、精製ステップ数、タンパク質収量、溶出効率、コスト等に影響を与えます。本稿では、一般的に利用されるタンパク質精製用の各種アフィニティタグに関する概要を紹介します。
|
His-tag(Hisタグ、ヒスタグ) 関連製品
- 6残基以上のヒスチジンからなります。多くの場合、その他の精製用タグと併用されます。
- ニッケル(Ni2+)やコバルト(Co2+)等の中心金属となる金属イオンと配位錯体(キレート)を形成します。
- イミダゾールを含有するバッファーを用いて競合的に溶出することが可能であり、タンパク質を変性させずに溶出することができます。
- 非常に低価格で、ニッケル(Ni)やコバルト(Co)との結合能が高いことから、最も一般的に用いられているアフィニティタグです。
- ヒスチジン含有量の高い内在性タンパク質もNi‐樹脂担体やCo‐樹脂担体に結合してしまうため、バックグラウンドがやや高くなる傾向があります。
- 金属結合タンパク質の精製には使用できません。
|
 |
|
FLAG®-tag(Flag®タグ) 関連製品
- 1xFlag®タグのアミノ酸配列:DYKDDDDK(8残基)
3xFlag®タグのアミノ酸配列:DYKDHD-G-DYKDHD-I-DYKDDDDK
タグ末端にエンテロキナーゼの切断部位(アミノ酸配列:DDDDK)が含まれます。
- 人為的に作られたペプチドタグです。
- Flag®タグ抗体と結合します。
- Flag®タグペプチドを用いた競合溶出法、または低pH下でタンパク質を変性させずに溶出します。
- 高コスト:樹脂担体の再利用が制限されることに加え、結合能、タンパク質収率が比較的低い傾向にあります。
|
 |
|
Spot-tag®(Spotタグ、スポットタグ) 関連製品
- アミノ酸配列:PDRVRAVSHWSS(12残基)
- ヒトβカテニン由来のペプチドタグで、抗Spot-tag® VHH抗体(Nanobody®)との結合に最適化されたアミノ酸配列で構成されています。
- 抗Spot-tag® VHH抗体(Nanobody®)と結合します。
- 低濃度のSpotペプチドを用いた競合溶出法、または低pH下でタンパク質を変性させずに溶出することができます。
- タグ挿入部位やバッファー組成の制約が少なく、実験計画の自由度が高まります。
- 低コスト:結合能が高く、樹脂担体の再利用が可能です。
|
 |
|
C-Tag(Cタグ)
- アミノ酸配列:EPEA(4残基)
- C末端にしか付加できません。
- 高濃度のSEPEAペプチドによる競合溶出法、または塩濃度が高く(例:2M MgCl2)かつ酸性条件の溶液で、タンパク質を変性させずに溶出します。
- タンパク質のC末端側にしか挿入できないため自由度が制限されます。
|
 |
|
Strep-tag®(ストレップタグ)
- アミノ酸配列(Strep-tag® Ⅱの場合):WSHPQFEK(8残基)
- 人為的に作られたペプチドタグで、ストレプトアビジンと良好に結合できるよう最適化されたタグです。
- ストレプトアビジンと結合します。
- デスチオビオチンを用いてタンパク質を変性させずに溶出します。
- 培地に含まれるビオチンが原因となり、分泌されたStrepタグ融合タンパク質が樹脂担体に結合しにくい場合があります。
- 目的タンパク質を発現させる宿主由来のビオチン化タンパク質がコンタミネーションする場合があります。
|
 |
|
GST-tag(GST(Glutathione-S-Transferase)タグ) 関連製品
- 分子量:約26kDa(211アミノ酸残基)
- GSTは発現量が多く、細胞の防御機構に関与するタンパク質です。
- 抗GST VHH抗体(Nanobody®)またはグルタチオンと強固に結合し、樹脂担体への残存は少ない傾向にあります。
- 還元型グルタチオンを用いて溶出します。
- GSTタグによってタンパク質の溶解性が向上し、可溶性タグ融合タンパク質の発現量が増加します。
- GSTタグは多量体からなるタンパク質複合体の精製には適していません。
- タグの分子量が大きいため、目的タンパク質の機能に干渉する可能性があります。したがって、精製ステップの後にタグを除去する場合があります。
|
 |
|
MBP-tag(MBP(Maltose binding protein)タグ) 関連製品
- 分子量:42kDa(370アミノ酸残基)
- 抗MBP VHH抗体(Nanobody®)またはアミロースと強固に結合し、樹脂担体への残存は少ない傾向にあります。
- マルトースを用いて溶出します。
- GST-tagよりも溶解性の向上に優れ、また、正確なタンパク質フォールディングを促進します。
- MBPタグは多量体からなるタンパク質複合体の精製には適していません。
- タグの分子量が大きいため、目的タンパク質の機能に干渉する可能性があります。したがって、精製ステップの後にタグを除去する場合があります。
|
 |









