蛍光タンパク質タグ
GFPやRFP等の内因性蛍光タンパク質タグとHaloタグやSNAP/CLIPタグ等の外因性蛍光タンパク質を比較・解説します。
はじめに
蛍光タンパク質(FP:Fluorescent protein)は、1990年代半ばから、主に細胞生物学や蛍光顕微鏡観察の分野でタンパク質タグとして使用されてきました。蛍光タンパク質タグは、ほぼすべてのタンパク質のイメージングを可能にすることで細胞生物学に革命をもたらしただけでなく、生化学的なアプリケーションでも使用されています。生化学アプリケーションの重要な例として、蛍光タンパク質を融合したタンパク質の免疫沈降(IP:Immunoprecipitation)やアフィニティ精製等が挙げられます。蛍光タンパク質タグの生化学的実験手法への利用は、クロモテック(2020年よりプロテインテックの一部)のNano-Trapのような、目的タンパク質を、高収率、高純度かつ高い親和性で回収できるアフィニティ樹脂担体の開発によって実現しました。
本稿では以下の項目について解説します。
- 緑色蛍光タンパク質(GFP:green fluorescent protein)
- 赤色蛍光タンパク質(RFP:red fluorescent protein)
- Haloタグ、SNAPタグ、CLIPタグ(自己標識化タンパク質タグ)
蛍光タンパク質の種類
多くの研究者は、「内因性蛍光タンパク質(intrinsically fluorescent protein:蛍光特性を示す内因的な発色団形成機構を持つタンパク質)」である、GFP、mNeonGreen、TurboGFP、RFP、mCherry等を使用します。内因性蛍光タンパク質の代わりに、SNAPタグ、CLIPタグ、Haloタグ等の「外因性蛍光タンパク質(extrinsically fluorescent protein:非蛍光タンパク質であるが、自己標識化タンパク質とも呼ばれ、外因性の蛍光標識リガンドの添加によって蛍光特性が付与されるタンパク質)」に蛍光分子を共有結合させて使用する場合もあります。外因性蛍光タンパク質は、標識する蛍光色素の特性によって、内因性蛍光タンパク質よりも有利な性能を発揮する場合があります。
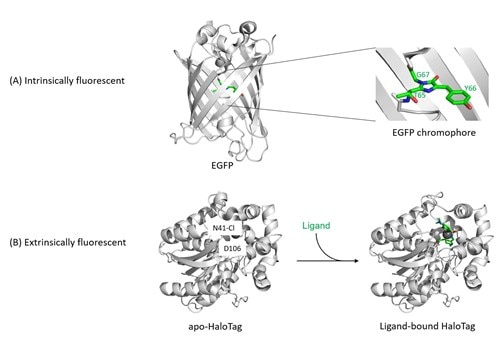
図1. 蛍光タンパク質の構造
(A) EGFP、GFP、RFP、mNeonGreen、turboGFP等の内因性蛍光タンパク質は、互いに相同性が低く、一致するアミノ酸配列はごくわずかですが、非常に類似したβバレル構造を形成します。内因性蛍光タンパク質は、βバレル構造の中心部に位置する、3つのアミノ酸残基の酸化と環化による環状構造形成によって、2つの環状構造を有する発色団が形成されることで蛍光を発するようになります(右:発色団の拡大図)。発色団形成の化学的プロセスは、蛍光発色団の成熟化とも称されるタンパク質フォールディング時に自発的に生じる現象で、温度や酸素濃度のような環境的要因に依存しますが、酵素の作用は受けません。種々の内因性蛍光タンパク質が示す色調、蛍光持続時間、量子収率、その他のスペクトル特性の違いは、発色団を形成するアミノ酸残基の変異や、発色団に近接するアミノ酸残基の変異によるものです。
(B) Haloタグ等の外因性蛍光タンパク質(自己標識化タンパク質)は、基本的には「アポタンパク質」の状態であり、タンパク質単体では蛍光を発する能力がありません。Haloタグに特異的な蛍光リガンドを添加してインキュベーションすることで、HaloタグのD106残基に蛍光色素が捕捉されて共有結合を形成し、蛍光を発するようになります。
参照タンパク質構造:EGFP(PDB ID:2y0g)、apo-Halotag(PDB ID:5uy1)、holo-Halotag(PDB ID:5uxz)。
緑色蛍光タンパク質(GFP:green fluorescent protein)
オワンクラゲ(Aequorea Victoria)に由来する緑色蛍光タンパク質(GFP:green fluorescent protein)とその組換え体は、医学生物学研究において最も頻繁に使用されている蛍光タンパク質です。近年、従来のGFPとは異なる、クラゲ以外の生物に由来する緑色蛍光タンパク質が新たに導入されています。別種由来の緑色蛍光タンパク質は、クラゲ由来のGFPと同様の基本構造を有しますが、アミノ酸配列は大きく異なります。したがって、新たに導入された蛍光タンパク質には、特異的な抗体等の専用の研究ツールが新規で必要となります。
GFPの由来
GFPは、1962年に下村脩(しもむら おさむ)博士によって単離されました。GFPは大きなストークスシフト(励起波長:395nm、蛍光波長:509nm)を示します。GFPの発見から約30年後、Douglas Prasher博士がGFPの遺伝子をクローニングし、Martin Chalfie博士がその配列のin vivo発現に成功しました。その後、Roger Tsien博士のラボがGFPを改良し、一般的に利用できる研究ツールへと改変しました。2008年、下村博士、Chalfie博士、Tsien博士は、その業績を評価され、ノーベル化学賞を受賞しました。Roger Tsien博士のノーベル賞受賞講演はこちらから視聴可能です(外部サイト:「Nobelprize」オフィシャルページ)。
研究者らは、多品種にわたる様々な特性を有するGFPバリアント(誘導体、変異体/改変体)を開発しました。一連のGFPバリアントは、様々な機能特性や異なるスペクトル特性を有します。特に重要なGFPの改良体としては、蛍光シグナルの強度や持続時間を向上させたS65T変異体(GFP(S65T))が挙げられます。GFP(S65T)の主要な励起波長は488nmにシフトしています(Heim, et al. 1995)。また、よく知られているバリアントの1つであるEGFP(enhanced GFP)は、GFPの組換え体であり、様々な生物や細胞に適用できる実用的なGFPとして使用される機会が増えています。
オワンクラゲ由来の野生型GFPは、avGFP、wtGFP、gfp10とも呼ばれます。GFPバリアントの1つであるEGFPは、GFPmut1とも呼ばれています。
野生型GFP情報:https://www.fpba-se.org/protein/avgfp/
EGFP情報:https://www.fpbase.org/protein/egfp/
TurboGFP
TurboGFPは、蛍光を発するまでの時間が短く、蛍光強度の強い、カイアシ類(Pontellina plumata)のCopGFPに由来する2004年に報告された緑色蛍光タンパク質です。カイアシ類由来TurboGFPは、EGFP等のオワンクラゲ由来の蛍光タンパク質とは進化的に遠縁の関係にあり、一般的に用いられるオワンクラゲGFPバリアントとの配列の相同性はわずか20%程度です。したがって、クロモテック(2020年よりプロテインテックグループ)の免疫沈降(IP)用試薬であるGFP-Trap®に用いられている抗GFP VHH抗体(Nanobody®)等のGFP抗体はほとんどTurboGFPと結合しません。
TurboGFP情報:https://www.fpbase.org/protein/turbogfp/
mNeonGreen
mNeonGreenは、ニシナメクジウオ(Branchiostoma lanceolatum)の多量体型黄色蛍光タンパク質に由来する単量体型蛍光タンパク質です。したがって、mNeonGreenはオワンクラゲ由来の蛍光タンパク質バリアントとは進化的に遠縁の関係にあり、一般的に用いられるオワンクラゲに由来するGFPバリアントとの配列の相同性はわずか20%程度です。各種オワンクラゲGFPバリアントとmNeonGreen間の相同性が低いことから、オワンクラゲGFPバリアントに対する一般的なアフィニティ結合ツールであるGFP抗体は、mNeonGreenには結合しません。実際にクロモテックの抗GFP VHH抗体(Nanobody®)は、mNeonGreenと結合しないことが明らかになっています。
2013年に初めて報告されたmNeonGreenは、GFPよりも3倍程度明るい蛍光シグナルを示します。mNeonGreenは、超解像顕微鏡観察等のイメージングアプリケーション用の多目的に使用できる単量体型の緑色/黄色蛍光タンパク質として登場しました。さらに、mNeonGreenは蛍光共鳴エネルギー移動(FRET:fluorescence resonance energy transfer)の原理を用いた蛍光観察において、シアン系蛍光タンパク質のアクセプターとして使用することができます。mNeonGreenは、最も明るい単量体型緑色蛍光タンパク質の1つであり、蛍光を発するまでに要する成熟時間が短いという特長を示します。
mNeonGreen情報:https://www.fpbase.org/protein/mneongreen/
GFP、TurboGFP、mNeonGreenの比較
特性 |
EGFP
|
turboGFP |
mNeonGreen |
|---|---|---|---|
|
発見/最初の論文投稿 |
1995 |
2004 |
2013 |
|
由来 |
オワンクラゲ(Aequorea Victoria)由来 |
カイアシ類(Pontellina plumata)由来 |
ニシナメクジウオ(Branchiostoma lanceolatum)由来 |
|
成熟時間(37℃) |
25分 |
25分 |
10分 |
|
EGFPとの相同性 |
(100%) |
~20% |
~20% |
|
オワンクラゲ由来GFPバリアントであるか |
〇 |
× |
× |
|
構造 |
単量体/二量体(弱い二量体を形成) |
二量体 |
単量体 |
|
類似バリアント |
AcGFP、Clover、eGFP、Emerald、GFP、GFP5、GFP Envy、GFP S65T、mGFP、mPhluorin、PA-GFP、Superfolder GFP、TagGFP、TagGFP2、monomeric eGFP A206K、CFP、eCFP、mCerulean、YFP、Citrine、eCitrine、eYFP、Venus、Ypet、BFP |
TurboGFP、CopGFP |
mNeonGreen |
|
最大励起波長/最大蛍光波長 |
488 nm / 507 nm |
482 nm / 502 nm |
506 nm / 517 nm |
|
鎖長/分子量(kDa) |
アミノ酸残基数:239残基 |
アミノ酸残基数:2x 232残基 |
アミノ酸残基数:236残基 |
|
関連製品 |
免疫沈降: 免疫蛍光染色: ウェスタンブロット: タグコントロールタンパク質: |
免疫沈降: TurboGFP-Trap |
免疫沈降: ウェスタンブロット:
|
赤色蛍光タンパク質(RFP:red fluorescent protein)
赤色蛍光タンパク質(RFP:red fluorescent protein)は、赤~橙色の蛍光を発する蛍光タンパク質の総称です。赤色蛍光タンパク質の中で最初に市場で販売開始されたのは、DsRedという蛍光タンパク質です。DsRedは、1999年にイソギンチャクモドキ(Discosoma sp.)から単離されました。
DsRedには実験に使用するにあたって、(ⅰ)成熟に約24時間を要するため、実験内容によっては使用できない場合があり、(ⅱ)四量体タンパク質であるため分子量が大きく、DsRedを融合させるタンパク質の機能を損なう可能性があり、(ⅲ)蛍光の持続時間がやや短いという、問題がありました。
そのため、遺伝子組換え技術を用いて目的タンパク質に挿入・融合するためのタグとして利用できるように部位特異的変異導入によって改変されました。現在では、蛍光のシグナル強度や持続時間が改良された単量体型RFP(mRFP)や、成熟に要する時間が短くなったバリアントが創出されています。他にも、橙色、赤色、近赤外色等の蛍光タンパク質バリアントが考案されています。単量体型RFPとして、mCherry、mOrange、mRaspberry、mPlumを含むmFruits類、mKO、mRFP(別名:mRFP1)、mRFPruby、tagRFP、mRuby、mKate2等が挙げられ、非常に重要な研究用ツールとなっています。
上記のRFP以外に、花虫類(例:イソギンチャク、サンゴ)からも赤色蛍光タンパク質が同定されています。しかし、発見されたタンパク質はその多くが三量体や、より大きな多量体でした。そのため、新たに発見された赤色蛍光タンパク質を研究に使用するには、さらなる改良が必要とされています。
mRFP(別名:mRFP1)
Roger Tsien博士のラボが遺伝子組換え技術によって作出した最初のdsRedの単量体バリアントは、単量体型の赤色蛍光タンパク質(monomeric red fluorescent protein)を意味するmRFP(別名:mRFP1)と命名されました。dsRedと比較すると、mRFP1はわずかにモル吸光係数、量子収率、蛍光の持続時間が劣ります。しかし、mRFP1の成熟時間はDsRedと比べて約10倍程度早いため、生細胞中で発現させるとほぼ同等の明るさの蛍光を観察できます。
mRFP(mRFP1)情報https://www.fpbase.org/protein/mrfp1/
mCherry
mCherryはおそらく、最もよく使用されているRFPバリアントの1つです。mCherryは、様々な種類の細胞のタンパク質に融合させることのできる応用範囲の広い単量体型赤色蛍光タンパク質です。mCherryは、mFruit RFP類と同様に、Roger Tsien博士のラボによって作出されました。mCherry は、dsRedのバリアントであるmRFP1をさらに改良して得られた蛍光タンパク質です。その他のmFruitsファミリーのタンパク質と比較すると、mCherryは蛍光の持続時間が長く、成熟時間は短く、優れたpH耐性を示します。しかし、量子収率はmRFPよりも低くなります。
mCherry情報:https://www.fpbase.org/protein/mcherry/
mPlum
Roger Tsien博士のラボでは、mRFP/dsRed由来の近赤外光に近い波長の蛍光を発する単量体型バリアントも作出し、mPlumと命名しています。近赤外蛍光タンパク質は、身体全体のイメージングを行いたい場合に非常に有用となります。なぜなら、水や脂質等の組織中の光を吸収・散乱させてしまう物質は650~900nmの波長をほぼ透過させ、ヘモグロビン等のごく限られた物質も近赤外波長領域の吸収は少ないため、生体の全身イメージングを実施できるからです。その他多くのRFP類と同様に、mPlumはストークスシフトの範囲が広いという特徴を示します。
mPlum情報:https://www.fpbase.org/protein/mplum/
mCherry、mRFP(mRFP1)、mPlumの比較
特性 |
mCherry |
mRFP
|
mPlum |
|---|---|---|---|
|
発見/最初の論文投稿 |
2004 |
2002 |
2004 |
|
由来 |
イソギンチャクモドキ(Discosoma sp.)由来 |
イソギンチャクモドキ(Discosoma sp.)由来 |
イソギンチャクモドキ(Discosoma sp.)由来 |
|
成熟時間(37℃) |
15分 |
60分 |
100分 |
|
構造 |
単量体 |
単量体 |
単量体 |
|
凝集 |
× |
× |
× |
|
最大励起波長/最大蛍光波長 |
587 nm / 610 nm |
584 nm / 607 nm |
590 nm / 649 nm |
|
鎖長/分子量(kDa) |
アミノ酸残基数:236残基 |
アミノ酸残基数:225残基 |
アミノ酸残基数:226残基 |
|
関連製品 |
免疫沈降: |
免疫沈降: |
免疫沈降: |
Haloタグ、SNAPタグ、CLIPタグ
Haloタグ、SNAPタグ、CLIPタグは、小型の蛍光リガンドを共有結合によって捕捉し、蛍光特性が付与される外因性蛍光タンパク質タグです。外因性蛍光タンパク質タグは、自己標識化タンパク質タグ(self-labeling protein tag)とも呼ばれ、化学結合の形成を触媒する酵素に由来します。SNAPタグやCLIPタグは、それぞれベンジルグアニン(BG)やベンジルシトシン(BC)と反応するO6‐アルキルグアニン‐DNA‐アルキルトランスフェラーゼのバリアントです。Haloタグはハロアルカンデハロゲナーゼに由来し、クロロアルカン誘導体と反応します(図1)。
外因性蛍光タンパク質と内因性蛍光タンパク質は、両者とも目的タンパク質に融合させることで細胞内イメージングや存在の検出を行うことができるようになります。外因性蛍光タンパク質には、蛍光色素誘導体を添加する必要がありますが、内因性蛍光タンパク質よりも優れる点がいくつかあります。
- 量子収率が高く、蛍光持続時間が長くなります。
- 生細胞、固定細胞のどちらでも強い蛍光を観察できます。
- 様々な蛍光色素を選択できます。
- 1度融合タンパク質を設計すれば、異なる蛍光色素を選択してマルチカラーイメージング/マルチプレックス染色(多重染色)を実現することができます。
- 蛍光標識誘導体を添加することで初めて蛍光を発するようになります。
異なる基質/リガンド特性を示す3種類の外因性蛍光タンパク質が現在利用可能であるため、マルチプレックス染色(多重染色)実験において「生体直交的(生体内プロセスへの干渉を最小限に抑えつつ、選択的に分子を修飾すること)」に使用することが可能であり、内因性蛍光タンパク質と併用することもできます。
実験内容によっては、テトラメチルローダミン(TMR)、Oregon Green™、diAcFAM、クマリン系の細胞透過性リガンドを使用することもできます。細胞透過性リガンドは容易に細胞膜を透過して細胞内タンパク質を標識できます。細胞表面に存在するタンパク質を標識する場合は、代わりにAlexa Fluor® 488やAlexa Fluor® 660等の細胞膜を透過できない非細胞透過性蛍光色素が使用されたリガンドを用いると、迅速に標識・蛍光観察を実施することができます。
Haloタグ、SNAPタグ、CLIPタグの比較
特性 |
Haloタグ |
SNAPタグ |
CLIPタグ |
|---|---|---|---|
|
発見/最初の論文投稿 |
2008 |
2008 |
2008 |
|
由来 |
Rhodococcus rhodochrous由来 |
human O6-alkylguanine-DNA-alkyltransferase |
human O6-alkylguanine-DNA-alkyltransferase |
|
構造 |
単量体 |
単量体 |
単量体 |
|
反応基質 |
Chloroalkane(クロロアルカン)誘導体 |
O6-benzylguanine(O6‐ベンジルグアニン、BG)誘導体 |
Benzylcytosine(ベンジルシトシン、BC)誘導体 |
|
リガンド |
色素、蛍光色素、ビオチン(細胞透過性/細胞非透過性の両方で使用可)、免疫沈降用ビーズ標識リガンド |
色素、蛍光色素、ビオチン(細胞透過性/細胞非透過性の両方で使用可)、免疫沈降用ビーズ標識リガンド |
色素、蛍光色素、ビオチン(細胞透過性/細胞非透過性の両方で使用可)、免疫沈降用ビーズ標識リガンド |
|
最大励起波長/最大蛍光波長 |
標識蛍光色素の特性に依存 |
標識蛍光色素の特性に依存 |
標識蛍光色素の特性に依存 |
|
鎖長/分子量(kDa) |
アミノ酸残基数:297残基 |
アミノ酸残基数:182残基 |
アミノ酸残基数:182残基 |
|
関連製品 |
免疫沈降: |
免疫沈降: |
免疫沈降: |
Haloタグ(HaloTag)
Haloタグは、Rhodococcus rhodochrous(ロドコッカス・ロドクラウス)のハロアルカンデハロゲナーゼ(haloalkane dehalogenase)に由来する「自己標識化タンパク質タグ」です。Haloタグの活性部位は遺伝子組換え技術により改良され、クロロアルカンリンカー基質と不可逆的に結合します。いわゆる「自殺阻害剤(suicide inhibitor)」のように触媒中心で不可逆的に共有結合を形成するため、1度リガンドと複合体を形成すると、触媒中心が塞がれ、それ以降にその他のリガンドは結合することができなくなります。タグを結合させる物質に依存して、Haloタグは蛍光タンパク質タグとしてイメージング等に用いられたり、アガロースビーズに固定化して免疫沈降やタンパク質精製に用いられたりします。
ハロアルカンデハロゲナーゼは、真核生物の細胞やE. coli(大腸菌)をはじめとするほとんどの原核生物には存在しないため、標識バックグラウンドは認められないとされています。
SNAPタグ(SNAP-tag)
SNAPタグは、ヒトO6‐アルキルグアニン‐DNA‐アルキルトランスフェラーゼ(hAGT)に由来する「自己標識化タンパク質タグ」です。O6‐アルキルグアニン‐DNA‐アルキルトランスフェラーゼは、本来はアルキル化によるDNA損傷部位を修復する酵素です。SNAPタグに使用されるhAGTバリアントは、O6-benzylguanine(O6‐ベンジルグアニン、BG)誘導体(例:ベンジルリンカーを介してグアニンやクロロピリミジン脱離基に結合した標識用蛍光色素)と反応し、非常に高い特異性で不可逆的な共有結合を形成します。標識反応の際は、基質のベンジル基が置換してSNAPタグに共有結合します。
CLIPタグ(CLIP-tag)
CLIPタグは、SNAPタグを遺伝子組換え技術によってベンジルグアニン(BG)ではなくベンジルシトシン(BC)と反応するように改良したバリアントです。SNAPタグと共に使用する場合でも、CLIPタグはSNAPタグとは独立して反応し、同一細胞中の2種類のタンパク質をそれぞれのタグに対応する色素で同時に標識することができます。
参考文献
「A guide to choosing fluorescent proteins」
Shaner N.C., Steinbach P.A. and Tsien R.Y. (2005)
Nature Methods 2(12), 905-909 doi: 10.1038/nmeth819
緑色蛍光タンパク質(GFP:green fluorescent protein)
「The green fluorescent protein」
Tsien R.Y. (1998)
Annual Review of Biochemistry, 67(1), 509-544. doi: 10.1146/annurev.biochem.67.1.509.
「Improved green fluorescence」
Heim, R., Cubitt A.B. and Tsien R.Y. (1995)
Nature, 373, 663-664. doi: 10.1038/373663b0
「Structural basis for the fast maturation of Arthropoda green fluorescent protein」
Evdokimov A.G., Pokross M.E., Egorov N.S., Zaraisky A.G., Yampolsky I.V., Merzlyak E.M., Shkoporov A.N., Sander I, Lukyanov K.A and Chudakov D.M. (2006)
EMBO reports, 7(10), 1006-1012. doi: 10.1038/sj.embor.7400787.
「A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum」
Shaner N.C., Lambert G.G., Chammas A., Ni Y., Cranfill P.J. Baird M.A., Sell B.R., Allen J.R., Day R.N., Israelsson M, Davidson M.W. and Wang J. (2013)
Nature Methods, 10(5), 407-409. doi: 10.1038/nmeth.2413
赤色蛍光タンパク質(RFP:red fluorescent protein)
「Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein」
Shaner N.C., Campbell R.E., Steinbach P.A., Giepmans B.N.G., Palmer A.E. and Tsien R.Y. (2004)
Nature Biotechnology, 22(12), 1567-1572. doi: 10.1038/nbt1037
「A monomeric red fluorescent protein」
Campbell R.E., Tour O., Palmer A.E., Steinbach P.A., Baird G.S., Zacharias D.A. and Tsien R.Y. (2002)
PNAS, 99(12), 7877-7882. doi: 10.1073/pnas.082243699
「Evolution of new nonantibody proteins via iterative somatic hypermutation」
Wang L., Jackson W.C., Steinbach P.A. and Tsien R.Y. (2004)
PNAS, 101(48), 16745-16749. doi: 10.1073/pnas.0407752101.
「Recovery of Red Fluorescent Protein Chromophore Maturation Deficiency through Rational Design」
Moore M.M., Oteng-Pabi S.K., Pandelieva A.T., Mayo S.L. and Chica R.A. (2012)
Plos ONE, 7(12), e52463. doi: 10.1371/journal.pone.0052463.
Haloタグ、SNAPタグ、CLIPタグ
「Releasable SNAP-tag Probes for Studying Endocytosis and Recycling」
Cole N.B. and Donaldson J.G. (2012)
ACS Chemical Biology,7(3): 464-469, doi: 10.1021/cb2004252
「Site-Specific Protein Labeling with SNAP-Tags」
Cole N.B. (2013)
Current protocols in protein science / editorial board, Coligan J.E. et al., 73: 30.1.1-30.1.16., doi: 10.1002/0471140864.ps3001s73
「An engineered protein tag for multiprotein labeling in living cells」
Gautier A., Juillerat A., Heinis C., Corrêa I.R., Kindermann M., Beaufils F. and Johnsson K. (2008)
Chemistry and Biology 15 (2): 128–136, doi: 10.1016/j.chembiol.2008.01.007
「HaloTag: A Novel Protein Labeling Technology for Cell Imaging and Protein Analysis」
Los G.V., Encell L.P., McDougall M.G., Hartzell D.D., Karassina N., Zimprich C, Wood M.G., Learish R, Friedman-Ohana R, Urh M., Simpson D., Mendez J., Zimmerman K., Otto P., Vidugiris G., Zhu J., Darzins A., Klaubert D.H., Bulleit R.F. and Wood K.V. (2008)
ACS Chem. Biol. 3(6): 373–382 doi: 10.1021/cb800025k
「A general method for the covalent labeling of fusion proteins with small molecules in vivo」
Keppler A., Gendreizig S., Gronemeyer T., Pick H., Vogel H. and Johnsson K (2003)
Nat. Biotechnol. 21: 86–89, doi: 10.1038/nbt765
「Fluorescent Labeling of COS-7 Expressing SNAP-tag Fusion Proteins for Live Cell Imaging」
Provost C.R. and Sun L. (2010)
Visualized Exp. 39: 1876, doi: 10.3791/1876
本稿で紹介した商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
旧ChromoTek(クロモテック)社の製品および技術は、ChromoTek GmbHの特許および出願中の特許により保護され、ChromoTek GmbHが独占的ライセンスにより利用しています。
「ChromoTek」、「Chromobody」、「F2H」、「GFP-Trap」、「Myc-Trap」、「RFP-Trap」、「Spot-Tag」、「Spot-Label」、「Spot-Trap」は、ChromoTek GmbHの商標または登録商標です。「SNAP-tag」、「CLIP-tag」はNew England Biolabs, Inc.の登録商標です。「Nanobody」はAblynx社(現Sanofi company傘下)の登録商標です。その他の製品は、それぞれ対応するサプライヤーの商標または登録商標である可能性があります。他社の製品に関する記述は、当社の知見に基づくものです。
関連情報
Why are recombinant Nanobodies/ VHHs beneficial?
Green fluorescent protein (GFP) in plant research
The best anti-GFP antibody for immunoprecipitation: GFP-Trap
What GFP-Trap should I use for my immunoprecipitation?
TurboGFP: Properties, Sequence, MW, origin
Mass spec-compatible immunoprecipiation for GFP, mNeonGreen, Myc, RFP, Spot, and TurboGFP
GFP Nanobody for better images in immunofluorescence
GFP and RFP-Booster for better immunofluorescence imaging
New anti-mNeonGreen antibody & Nano-Trap for Immunofluorescence & Immunoprecipitation


