タンパク質タグの長所と短所
タンパク質にタグを融合させた方が有益な場合、融合させない方が良い場合について、それぞれのメリットとデメリットを解説します。
Sophie Williams著(ブリストル大学博士研究員)
組換え(リコンビナント)タンパク質作製時に「タグ」を融合・挿入する手法は、タンパク質研究において有用であり、強力なツールとなっています。研究対象とするタンパク質へのタグの挿入は、細胞ライセートからのタンパク質の精製を容易にし、タンパク質の細胞内局在のモニタリング、特性が明らかになっていないタンパク質の検出に役立ちます。現在までに、幅広い選択肢の中から様々なアフィニティタグ(タンパク質タグやペプチド/エピトープタグ)を選ぶことができるようになっています。しかし、本来のネイティブタンパク質内のアミノ酸配列には存在しないタンパク質タグやペプチドタグ配列の融合により、タンパク質に対する悪影響は生じないのでしょうか?
分子生物学的研究では、GFPタグ(Green fluorescent protein、緑色蛍光タンパク質)、MBPタグ(Maltose binding protein、マルトース結合タンパク質)、GSTタグ(Glutathione S-transferase、グルタチオン‐S‐トランスフェラーゼ)等の比較的分子量の大きなタンパク質タグを含む様々な種類のタンパク質タグが日常的に使用されます。あるいは、His-tag(ポリヒスチジンタグ)、Strep-tag®(ストレプトアビジンタグ)等の、数個~十数個のアミノ酸配列からなる比較的分子量の小さなペプチドタグを組換えタンパク質に挿入する場合もあります。一般的にタンパク質タグやペプチドタグは、対象タンパク質の特性(例:細胞内局在化に重要な配列の有無、翻訳後の切断部位や翻訳後修飾部位の存在)に応じてタンパク質のN末端またはC末端のいずれかに挿入されます。
適用するタグの検討時に考慮すべきポイント
実験系でどのタンパク質タグを使用するか検討する際にいくつかの考慮すべきポイントがあります。
-
タグが対象タンパク質の構造および機能に与える影響
-
対象タンパク質とタグ間のリンカー配列の必要性
-
タグの挿入部位
-
タグを除去するためのプロテアーゼ切断部位組込みの必要有無
-
組換えタンパク質を使用するアプリケーション
-
組換えタンパク質の必要量や発現量
さらにタグの中には対象タンパク質に特定の用途に適した特性を付与できるものがあります。前述の考慮すべき要素に加えて、以下に示す利点(メリット)を参考の上、総合的に使用するタグを決定しましょう。
タグ融合による特性付与の例(1):安定性
翻訳後修飾を必要とする特殊なタンパク質を発現させる場合、大腸菌(E. coli)のような一般的な発現系ではとりわけ困難を伴う可能性があります。大腸菌発現系は、多くの真核生物タンパク質で施される翻訳後修飾やプロセシングに必要な高度な機構が欠如しています。そのため、大腸菌を用いて真核生物タンパク質を発現させると、しばしばミスフォールディングタンパク質や封入体が産生されます。過去の研究では、研究に供したヒトタンパク質のうち75%までは大腸菌系で発現させることができたものの、機能性を示す可溶性タンパク質を発現できたものはわずか25%程度であったことが報告されています1。
タンパク質タグの中には、ターゲットタンパク質に付加することで安定性を改善できるものがあります。例を挙げると、MBPタグやGSTタグ、SUMOタグ(SUMO:small ubiquitin related modifier、ユビキチン様タンパク質)等の可溶化タグ(可溶性タグ/親水性タグ)は、不溶性タンパク質の可溶性向上のために汎用的に融合されます。このような比較的分子量の大きなタンパク質タグは、翻訳されると迅速にフォールディングされ、良好な可溶性を示す安定的なタンパク質として発現します。タンパク質タグの迅速なフォールディングにより、タグ融合組換えタンパク質のフォールディングが進行します。さらにタンパク質の可溶性や安定性が改善され、細胞内での凝集が防止されます。可溶化特性の付与は、タンパク質精製等のアプリケーションで高収量の組換えタンパク質が必要な場合に特に重要です。例を挙げると、ヒトインターフェロンγ(IFN-γ)は大腸菌で発現させると封入体を形成し凝集していましたが、SUMOタグ融合体として発現させることで機能を維持したタンパク質の状態で発現および精製することに成功しています6。
タグの対象タンパク質への融合は、膜タンパク質の発現および回収時にも寄与します。膜タンパク質は、かねてより知られるように発現や精製が困難な場合があります。多くの場合、膜タンパク質を過剰発現させると発現宿主に対して毒性を示すことに加え、界面活性剤を用いて細胞膜から抽出する必要があります。また組換え発現した膜タンパク質は、溶液中でしばしば不安定になる場合があります。しかし、タンパク質タグの融合は、膜タンパク質の安定性の改善に寄与する場合があることが示されています。例を挙げると、MBPタグは真核生物のGタンパク質共役受容体の発現を補助する目的で融合を試みた報告があり、SUMOタグは原核生物および真核生物の両者の膜タンパク質のフォールディングと安定性を改善することが報告されています3,4。
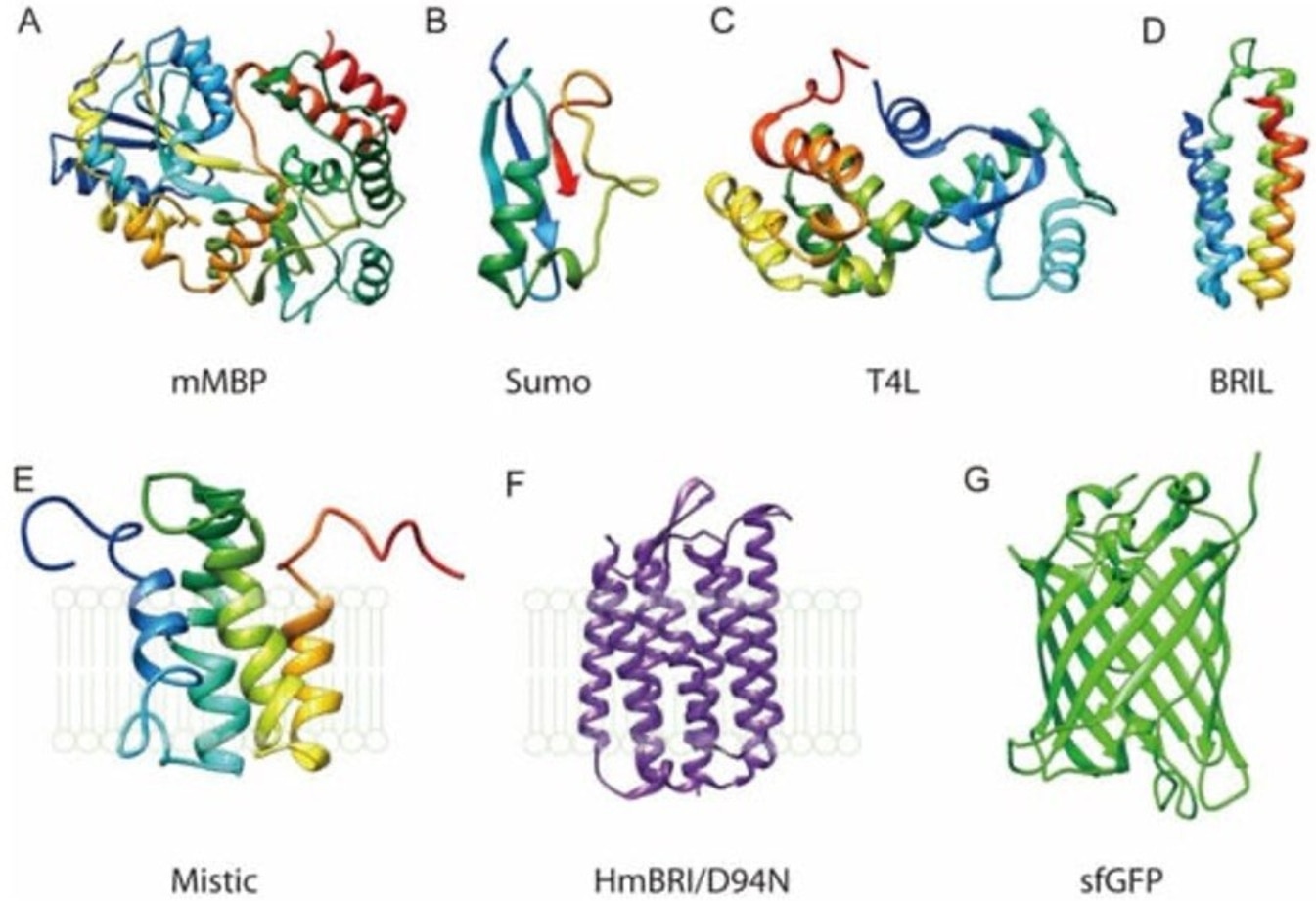
図1. 膜タンパク質を精製するためのタンパク質タグの例。図はLiu and Li, 2022(Crystals、オープンソース)3より引用。
タグ融合による特性付与の例(2):蛍光シグナル
GFPタグをはじめとする蛍光タンパク質は、蛍光イメージング技術と合わせて利用することによって、対象タンパク質の細胞内局在を直接的に可視化できるため、比較的迅速かつ簡便な局在解析/追跡用のタグとして利用されます。高度な空間分解能・時間分解能でターゲットタンパク質の局在、存在量、動静をモニタリングする目的で、このような蛍光プローブをターゲットタンパク質に融合させます。
タグ融合による特性付与の例(3):検出性
GFPタグとともに、FLAG®タグ(アミノ酸配列:DYKDDDDK)、c-mycタグ、HAタグ(ヘマグルチニン抗原タグ、HA:Hemagglutinin antigen)等の非蛍光性のタンパク質タグやエピトープタグは、免疫沈降(IP:Immunoprecipitation)やウェスタンブロット(WB:Western blot)等のアプリケーションを用いた検出実験に幅広く使用されます。検出用のタグをタンパク質に融合して発現させる戦略は、研究対象とするタンパク質の特性が十分に解明されていない場合や、対象タンパク質に対する優れた抗体が開発されていない場合は特に有用です。なお蛍光タンパク質タグの場合でも、検出用試薬を利用できる場合は、同様の用途に用いることができます。実際に、非蛍光性のタグと蛍光タンパク質タグを認識する従来型抗体やアルパカ由来VHH抗体(別名:Nanobody®)は既に市販されており、ウェスタンブロット(WB)、免疫沈降(IP)、アフィニティ精製等で良好に機能します。
タグ融合による特性付与の例(4):アフィニティ精製のための相互作用部位
組換えタンパク質を簡便かつ迅速に精製する有用な手法として、小分子(例:金属イオン)や特定のタンパク質(例:ストレプトアビジンや抗体等)に対して高い親和性(アフィニティ)を示すタグを使用する方法があります。実際にアフィニティクロマトグラフィーでは、先述の特性を示すHisタグ、Strep®タグ、GSTタグ等が利用されます。例を挙げると、HisタグはNi2+(ニッケル)やCo2+(コバルト)等の遷移金属イオンと高い親和性で結合します。この遷移金属イオンはビーズや樹脂等の固相担体に固定化することができます。具体的には、Hisタグ融合タンパク質を金属イオン固定化樹脂に結合させることで、その後の洗浄操作で目的タンパク質以外のコンタミネーションを洗い流すことができます。担体上の目的タンパク質は、Hisタグ中のヒスチジン残基と拮抗的に作用するイミダゾールを高濃度で含むバッファーを添加することにより溶出させることができます。
タンパク質タグ挿入の欠点
タンパク質タグやエピトープタグは、画期的なタンパク質研究ツールとして多くの研究者が利用していますが、タグを付加する前にいくつかの欠点(デメリット)を考慮する必要があります。
1. ターゲットタンパク質に対する未知の影響
タンパク質タグ(特に分子量の大きいタグ)の挿入は、ターゲットタンパク質の構造および機能特性に未知の影響を及ぼすおそれがあります。タグの挿入により、ターゲットタンパク質の機能の一部または全てが失われる可能性があります。例を挙げると、近年の研究では、分子量の小さなHisタグを挿入するだけで複数の酵素の活性が顕著に低下しました2,5。したがって、タグの融合がターゲットタンパク質の活性に影響するのか判断するには、野生型タンパク質と組換えタンパク質の活性を相互に評価する予備検討が必要になります。
2. タグ切断/除去後のタンパク質の不安定化
タンパク質を結晶化して解析する場合等の下流のアプリケーションを実施するにあたって、可溶化タグを切断/除去すると、タンパク質が再び不安定化するおそれがあります。そのため、タグの切断/除去によって組換えタンパク質が不安定化する場合や、下流のアプリケーションでタグフリーのタンパク質を必要とする場合、目的タンパク質の発現系をシャペロンとの共発現系に変更することや、結晶化時に抗体フラグメントを結合させるといった手法が有効である場合があります。シャペロン分子は、目的タンパク質の疎水性領域をシャペロンタンパク質内部に埋め込んでタンパク質の凝集を防ぎ、新生タンパク質が正確に折りたたまれるのをサポートします。タンパク質ジスルフィドイソメラーゼ(PDI:Protein disulfide isomerase)、GroES・GroEL、Trigger factor(TF)といったシャペロン分子は、発現が困難なタンパク質との共発現にしばしば使用されます。
3. タグを除去する追加ステップ
組換えタンパク質からのタンパク質タグの効率的な切断/除去は、多くの場合困難を伴い、手間がかかります。一般的にタンパク質タグの除去には、タグとタンパク質との間にプロテアーゼ切断部位を挿入、プロテアーゼを作用させます。「1. ターゲットタンパク質に対する未知の影響」で述べた内容と関連しますが、プロテアーゼ切断部位として導入したアミノ酸配列が目的タンパク質の構造や機能に影響を及ぼす可能性もあります。
4. 本来のタンパク質以外の配列の残存
一部の生物学的製剤は、すべてのタグ配列、リンカー配列、プロテアーゼ切断部位を除去し、本来のタンパク質の配列だけで構成されるように調製する必要があります。非ネイティブ由来の配列が存在すると、製剤の機能に干渉するおそれや、投与した際に免疫反応を引き起こすおそれがあります。生物学的製剤の先例を考慮し、例えばプロテインテックのHumanKine®組換えサイトカイン&増殖因子(RUOグレードおよびcGMPグレード)はすべての製品が「タグフリー」タンパク質として発現されます。
まとめ
総合的にみると、研究対象タンパク質へのタグの付加には利点と欠点がそれぞれ存在します。適用するアプリケーションや実験系を注意深く検討すれば、タンパク質タグやエピトープタグは貴重な研究ツールとなり、困難なタンパク質でも効率的な発現や調製につながるでしょう。
|
|
利点 |
欠点 |
タグ融合
|
· タグの親和性を利用したタンパク質精製を実施可能(例:アフィニティクロマトグラフィー) · ターゲットタンパク質の可溶性および安定性を改善 · タグフリータンパク質では不可能な事例でも、目的タンパク質を特異的に検出 · タンパク質の発現量増加および分解低減による収量の増加 |
· タグがタンパク質の構造および生物学的活性に干渉するおそれ · 下流のアプリケーションによってタグを切断/除去する必要性 · タグ除去後、タンパク質が不安定化する可能性 · 分子量の大きなタグの場合、発現宿主に対してより高い代謝負担を与える可能性 |
タグフリー
|
· タグの切断/除去操作が不要 · 本来のタンパク質の構造および生物学的活性に変化を与えない、ネイティブ様の組換えタンパク質発現が可能 |
· タンパク質精製および検出がより困難かつ複雑になる可能性 · タンパク質のミスフォールディングや不溶化が生じる場合、収量が低下し、改善するための追加の手順が必要 |
[関連製品]様々なタグを認識するVHH抗体(別名:Nanobody®)
クロモテック(2020年よりプロテインテックの一部)のNano-Trap(ナノトラップ)製品は、迅速かつ信頼性の高いワンステップの免疫沈降(IP)/プルダウンアッセイによって、発現量の少ないタンパク質であっても効率的に回収することが可能です。Nano-Trapは免疫沈降用ビーズと結合したVHH抗体(別名:Nanobody®)からなる製品で、すぐに使用できる状態で販売されています。Nano-Trapは、高い特異性を示すため、プルダウンアッセイ結果を著しく改善します。バックグラウンドが低く、目的タンパク質以外のバンドが認められない実験結果を提供します。
[関連製品]各種タグ抗体
一般的なタンパク質タグ/エピトープタグを認識する抗体やNano-Trap製品については、タグ抗体検索結果をご覧ください。
参考文献
- S Costa, A Almeida, A Castro, L Domingues. Fusion tags for protein solubility, purification and immunogenicity in Escherichia coli: the novel Fh8 system. Front Microbiol. 2014 Feb 19:5:63.
- A P Araújo, et al. Influence of the histidine tail on the structure and activity of recombinant chlorocatechol 1,2-dioxygenase. Biochem Biophys Res Commun. 2000 Jun 7;272(2):480-4.
- S Liu, W Li. Protein Fusion Strategies for Membrane Protein Stabilization and Crystal Structure Determination. Crystals. 2022, 12(8), 1041(mdpi.com)
- X Zuo, et al. Enhanced expression and purification of membrane proteins by SUMO fusion in Escherichia coli. J Struct Funct Genomics. 2005;6(2-3):103-11.
- A Panek, O Pietrow, P Filipkowski, J Synowiecki. Effects of the polyhistidine tag on kinetics and other properties of trehalose synthase from Deinococcus geothermalis. Acta Biochim Pol. 2013;60(2):163-6.
- M Tileva, E Krachmarova, I Ivanov, K Maskos, G Nacheva. Production of aggregation prone human interferon gamma and its mutant in highly soluble and biologically active form by SUMO fusion technology. Protein Expr Purif. 2016 Jan:117:26-34.

