野生型および変異型タンパク質の研究ガイド
Suparba Roy著(Laval大学、PhD Candidate)
はじめに
タンパク質は生命の根幹をなす分子です。本稿では、野生型タンパク質や変異型タンパク質の機能や構造について研究し、正常時・疾患時の両状態における身体に関する理解を深めるための手法を解説します。
SF映画では、突然変異が「超人的」な身体的特徴につながるように描写されることがありますが、実際の突然変異はそれほど刺激的な変化を引き起こしません。例えば、変異型タンパク質は、野生型タンパク質の抑制・阻害・過剰発現に働きかけたり、元の野生型タンパク質とは異なる新たな機能を獲得したりする場合があります。変異とは、ヌクレオチドの欠失・置換・挿入によって引き起こされるヌクレオチド配列の変化を指します。変異によってアミノ酸配列が変化すると、タンパク質のコンホメーション/立体構造の変化や制御機構の変化が生じることがあります。例えば、ある酵素(リボザイム等の例外を除き、酵素は基本的にタンパク質です)が構造変化を起こすと、活性部位・触媒部位の機能が損なわれ、基質が活性部位と結合できなくなる場合があります。
研究者は多大な努力を費やしてタンパク質の構造や機能について研究しているものの、いまだに解明されていないことも多く、今後も新たな発見があると見込まれています。
タンパク質機能の研究手段
タンパク質機能の研究は、大きく機能解析と構造解析の2種類に分類されます。
機能解析
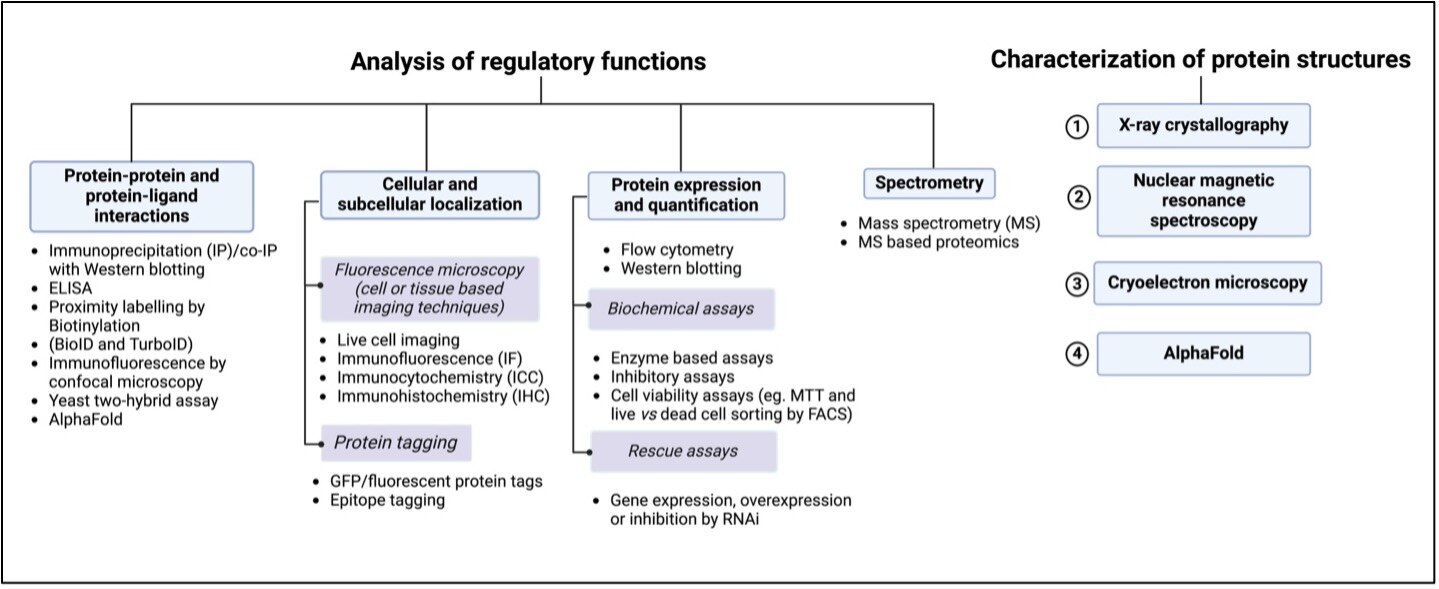
図1. タンパク質機能・タンパク質構造の研究ガイド
機能評価:タンパク質の制御機能を研究するには、機能アッセイを実施します。機能アッセイは様々な異なる条件下にあるタンパク質の活性を理解するのに役立ちます。生体由来のタンパク質を研究する場合は、生体試料からタンパク質を抽出・精製します。タンパク質精製の過程では、概して、最初に細胞からタンパク質を抽出し、遠心分離、SDS-PAGEによる解析、クロマトグラフィーによるタンパク質の分離・精製を経て、最終的に得られた精製タンパク質の定量等を実施します。一般的に、ウェスタンブロット(WB:Western blot)を実施する場合は細胞ライセートを調製する必要がありますが、In-cell western法という、細胞ライセートを調製せずに内在性タンパク質を検出する免疫細胞化学ツールも存在します。その他にも、内在性タンパク質は固定細胞や固定組織のイメージングによって研究されています。以下のセクションでは、薬剤や他の分子の関与も想定しつつ、野生型タンパク質や変異型タンパク質を研究するための様々な手法について詳しく解説します。
野生型タンパク質と変異型タンパク質を効率的に解析するには、ゲノムの遺伝子工学的な操作が必要で、ラボではこの手法が一般的に用いられています。例えば、トランスフェクション(非ウイルス系)やトランスダクション(ウイルスベクター系)の場合は、宿主細胞や宿主ゲノムに核酸を導入して変異型タンパク質を発現させます。さらに、様々なタンパク質発現検証ツールを利用して、適切に変異が導入されているのか検証します。このような手法を利用すれば、本来のタンパク質と変異型タンパク質の機能の違いを研究することが可能になります。
1. 研究対象となるタンパク質と、DNAやRNA等の核酸・リガンド・他のタンパク質との相互作用は、結合アッセイによって研究できます。この結合アッセイを用いることで、変異型タンパク質と野生型タンパク質の、タンパク質相互作用の比較研究が可能になります。広く一般的に実施されている結合アッセイとしては、免疫沈降(IP:Immunoprecipitation)や共免疫沈降(Co-IP)、質量分析(MS:Mass spectrometry)、目的タンパク質のビオチン標識アッセイ、ELISA、ウェスタンブロット、In-cell western法、酵母ツーハイブリッド法等が挙げられます。このように、結合アッセイは、変異がタンパク質機能に及ぼす影響を解明する目的で幅広く利用されています。例えば、結合アッセイを実施することで、野生型タンパク質が本来の機能を発揮するのに対し、変異型タンパク質はリガンド・基質・その他の物質と相互作用できず、その機能を発揮することができないといった、価値の高い重要な情報を得ることができます。さらに、タンパク質の機能を改変して疾患の原因となる変異を結合アッセイによって研究することで、様々な疾患の病態について調査することが可能になります。こうしたアッセイは薬剤の有効性を調査するために広範に使用されており、野生型タンパク質や変異型タンパク質の分子機構や機能を明らかにするだけではなく、疾患を治療するための創薬候補物質を発見するのに役立つ場合もあります。
プロテインテックの関連製品:免疫沈降(IP)
ELISAキット
ウェスタンブロット
2. タンパク質の機能は、タンパク質の存在する時空間的局在によって異なることが研究によって示されています。この現象は、様々なシグナル伝達カスケード、翻訳後修飾、ストレス誘導性の相互作用や活性の変化等に起因すると考えられ、タンパク質の局在に応じた機能について理解を深めるうえで重要な側面を持つと考えられます。目的タンパク質の細胞内小器官における局在や細胞内局在は、顕微鏡観察によって研究できます。顕微鏡観察は、時間と作業の両面で大きな負担を伴う手法ではありますが、需要の高い効果的な手法の1つで、その信頼性の高さには定評があります。一般的な例としては、顕微鏡を用いる免疫蛍光染色(IF:Immunofluorescence)を応用して実施する、免疫細胞化学(ICC:Immunocytochemistry)や免疫組織化学(IHC:Immunohistochemistry)等の手技が挙げられます。こうした手技では、一次抗体と蛍光色素を標識した二次抗体を使用して、細胞内または組織内の目的タンパク質を可視化します。顕微鏡を用いて、目的タンパク質の発現・局在パターン・目的タンパク質の近傍に存在するタンパク質との相互作用・細胞や組織の形態を観察することによって、野生型タンパク質と変異型タンパク質を区別することが可能になります。また、変異が生じた結果、野生型タンパク質が本来有する機能や典型的機能とは異なる機能を示す「機能獲得型」変異体が出現することがあります。タンパク質が変異することで機能喪失型や機能獲得型といった表現型を示すか否かは、顕微鏡観察によって確認することが可能です。その他にも、変異型タンパク質が、細胞増殖・細胞死・細胞極性・コロニー形成等に影響を与えるかどうかを、顕微鏡観察する手法を用いて野生型タンパク質と比較しながら研究を進めることができます。
プロテインテックの関連製品:免疫蛍光染色(IF)
3. 内在性タンパク質や分子の発現を研究するには、フローサイトメトリー(FC:Flow cytometry)を応用したFACS(Fluorescence-activated cell sorting)という手法が用いられます。FACSでは、特定の蛍光色素を標識した各細胞の光散乱特性と蛍光特性というシンプルな現象を利用して、不均一な細胞混合物から目的の細胞集団を分離します。極めて特異性の高い蛍光標識抗体を使用することで、特定の蛍光波長で発光する細胞を1細胞ごとに計測し、各イベントを解析することができます。この原理を利用して、野生型タンパク質と変異型タンパク質を発現する異なる細胞集団間の研究を行います。例えば、FACSを使用して、野生型タンパク質や変異型タンパク質を発現した細胞の酸化ストレスやミトコンドリアの膜電位等について調査研究することで、細胞の状態に関する様々な情報を得ることができます。ある種の変異型タンパク質はストレスを誘発し、細胞に細胞周期停止・細胞死・細胞老化・活動停止等を誘導します。また、DNA損傷の修復機構に悪影響を及ぼしたり、細胞周期チェックポイントの撹乱や迂回、細胞増殖の促進に働きかけたりすることで腫瘍形成能を示すものもあります。このような状態はFACSを使用して詳細に解明することが可能で、野生型タンパク質や変異型タンパク質が、細胞の包括的な生物学的プロセスや細胞の運命に影響を及ぼす仕組みを明らかにできます。
プロテインテックの関連製品:フローサイトメトリー用標識抗体
4. 細胞の運命は複数の要因に基づいて定められます。野生型タンパク質や変異型タンパク質の発現を細胞の生存能力の観点から研究することで、正常な状態の細胞に関する知見が得られ、細胞の活動や分子活性について理解を深めることが可能になります。変異によってタンパク質本来の機能は変化し、細胞の生存能力に影響を及ぼします。細胞の生存能力を研究するための一般的なアッセイは何種類かあり、代謝活性を測定するMTTアッセイ、生細胞を染色するトリパンブルー染色、死細胞を染色するヨウ化プロピジウム(PI)染色(FACS/FCで測定します)、生細胞を判別するATP/Luminescenceアッセイ(ATPの存在量を化学発光法により測定する手法です。生細胞や正常な細胞は死細胞よりも多くのATPが観測されるため、シグナル強度に基づいて生細胞や正常な細胞と死細胞の判別を行います)等が挙げられます。このような手法は、野生型タンパク質と変異型タンパク質の機能の違いを研究できる頑健性の高いアプローチであるのみならず、変異が細胞の健常性に総体的に影響を及ぼす仕組みについても調べることができる手法です。
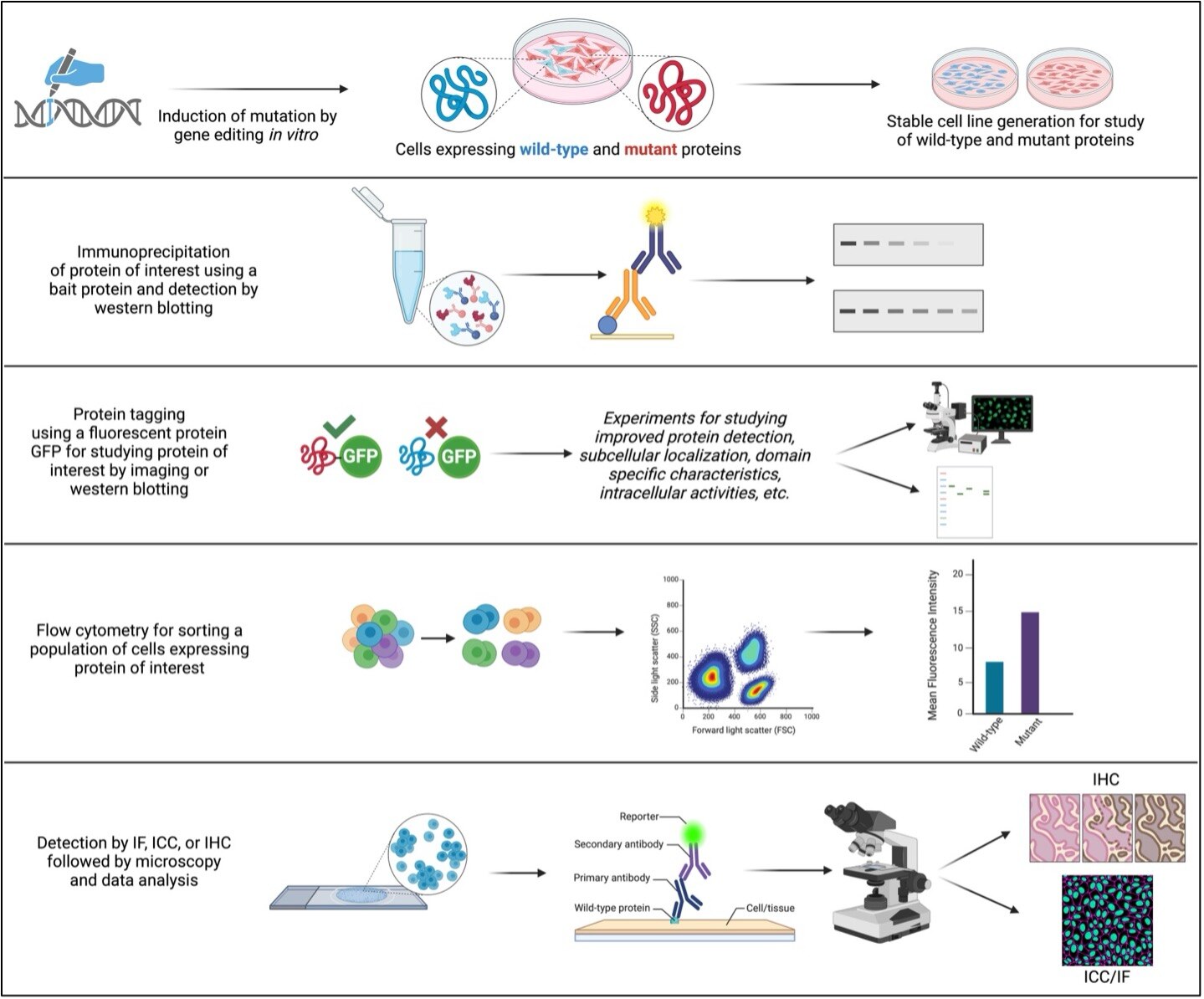
図2. 野生型タンパク質や変異型タンパク質を研究するための一般的な実験手法&関係する重要な手順の概略
(注:図の内容はすべて、各実験手法における一般的な手順を示したものです。実際に研究を行う際は、研究内容・使用サンプル・実験目的等に基づいて適宜変更する必要があります)
構造解析
構造解析では、タンパク質フォールディングによって形成されるタンパク質の三次元構造を特性解析します。タンパク質フォールディングは、翻訳後修飾とも密接に関連する重要な過程です。タンパク質のミスフォールディングはタンパク質の安定性に影響を及ぼすことから、原因となる変異が多様な疾患の一因となることが広く認知されています。この変異によるタンパク質ミスフォールディングはがんの大きな特徴の1つとされています。タンパク質のコンホメーション変化の研究は、したがって、タンパク質機能の解明において極めて重要な側面を担っています。野生型タンパク質と変異型タンパク質の立体配座異性体(Conformer)は、両者とも異なる機能を示します。この機能の違いは、変異タンパク質の不活性化、他の分子との結合作用障害、機能獲得型のような新たな活性の獲得に関与する変異に起因すると考えられます。長年にわたり、タンパク質構造や立体配座異性体の解析は、X線結晶構造解析、核磁気共鳴分光法(NMR)、クライオ電子顕微鏡等を用いた実験によって行われてきました。このような手法は非常に高精度であるものの、時間とコストの両面で大きな負担を伴います。近年では、生物学の分野において人工知能(AI)が活用され、これら2つの課題に対する取り組みが進められています。Google DeepMindは、タンパク質の三次元構造を数分程度で最大80%の精度で予測できるAlphaFoldというAIを基盤にした計算生物学ツールを開発しました。AlphaFoldは、遺伝子変異がタンパク質の構造や機能に与える影響の評価、タンパク質ポケットに結合する新薬候補の探索、タンパク質間相互作用に携わるタンパク質の相互作用モデルの計算、さらには創薬・バイオテクノロジー・農業・環境分野を対象とした、新たな機能を有するタンパク質の創出に活用されています。AlphaFoldは、タンパク質構造解析における革新的な成果を象徴する存在といえるでしょう。
最後に
様々な生体システムにおける分子を基盤とする多様なメカニズムを包括的に理解するには、タンパク質とその変異による機能変化の影響を解明することが重要となります。本稿では、免疫沈降やウェスタンブロットのような生化学アッセイから、より高度な顕微鏡観察やフローサイトメトリーのような手法まで、研究現場で幅広く活用されている実験手法を紹介しています。紹介した手法を慎重に選択し適用することで、タンパク質変異がタンパク質の発現・局在・相互作用、さらには細胞機能に影響を与える仕組みについて調べることが可能になります。野生型タンパク質と変異型タンパク質の研究は、創薬や疾患の解明だけにとどまらず、生物学や自然科学の未知の領域にも迫る、現在進行形で活発に研究されている分野です。CRISPR-Cas9による遺伝子編集、Deep mutational scanning、ハイスループットスクリーニングのような様々な技術革新が、タンパク質機能の探索や新規創薬ターゲットの発見に大きく貢献しています。今後の技術的進展により、タンパク質の機能や変異型タンパク質の影響を研究する手法はさらに高度化していくと考えられます。
参考文献
- M Mishra, S Tiwari, A V Gomes. Protein purification and analysis: next generation Western blotting techniques. Expert Rev Proteomics. 2017 Nov;14(11):1037-1053.
- C Deng, X Xiong, A N Krutchinsky. Unifying fluorescence microscopy and mass spectrometry for studying protein complexes in cells. Mol Cell Proteomics. 2009 Jun;8(6):1413-23.
- R I Krohn. The colorimetric detection and quantitation of total protein. Curr Protoc Cell Biol. 2011 Sep:Appendix 3:3H.
- J Picot, C L Guerin, et al. Flow cytometry: retrospective, fundamentals and recent instrumentation. Cytotechnology. 2012 Mar;64(2):109-30.
- Christopher M Dobson. Protein folding and misfolding. Nature. 2003 Dec 18;426(6968):884-90.
- C Xiong, H Ling, Q Hao, X Zhou. Cuproptosis: p53-regulated metabolic cell death? Cell Death Differ. 2023 Apr;30(4):876-884.
- L Gerasimavicius, B J Livesey, J A Marsh. Loss-of-function, gain-of-function and dominant-negative mutations have profoundly different effects on protein structure. Nat Commun. 2022 Jul 6;13(1):3895.
- M Wade、J Méndez、N P. Coussens、M R. Arkin、M A. Glicksman. Inhibition of Protein-Protein Interactions: Cell-Based Assays. Assay Guidance Manual. Bethesda (MD): Eli Lilly & Company and the National Center for Advancing Translational Sciences; 2004-.
- J Jumper, R Evans, A Pritzel, T Green, et al. Highly accurate protein structure prediction with AlphaFold. Nature. 2021 Aug;596(7873):583-589.
- B Alberts, R Heald, A Johnson, et al. Molecular Biology of the Cell, 7th ed. New York:W.W.NORTON & CO., 2022.


