
cGMPグレード組換えタンパク質 サイトカイン&増殖因子
再生医療研究分野を中心に、細胞培養技術を用いた自家細胞/他家細胞の培養加工の需要が急速に伸びています。同時に、適切な品質管理および安全性対策の観点から、高品質な原材料のニーズも高まってきています。
cGMPグレード準拠施設(米国)で製造される『HumanKine®(ヒューマンカイン)増殖因子&サイトカイン』は、ヒト細胞発現系で産生された組換えタンパク質であり、高い生物学的活性を発揮するために必要とされる適切な翻訳後修飾が施されています。HumanKine®(ヒューマンカイン)シリーズは、USPおよびWHOの基準に従い、プロテインテックのヒト細胞発現系を用いて製造されており、最大限の安全性および再現性を提供します。

-
ISO 13485認証取得
-
原材料の適格性評価
-
各製造工程で品質検査
-
アニマルフリー・ゼノフリーの製造工程
-
ISO規格に準拠した製造・充填用のクリーンルーム
-
規制対応サポート&監査対応可能施設
GMPグレード製品
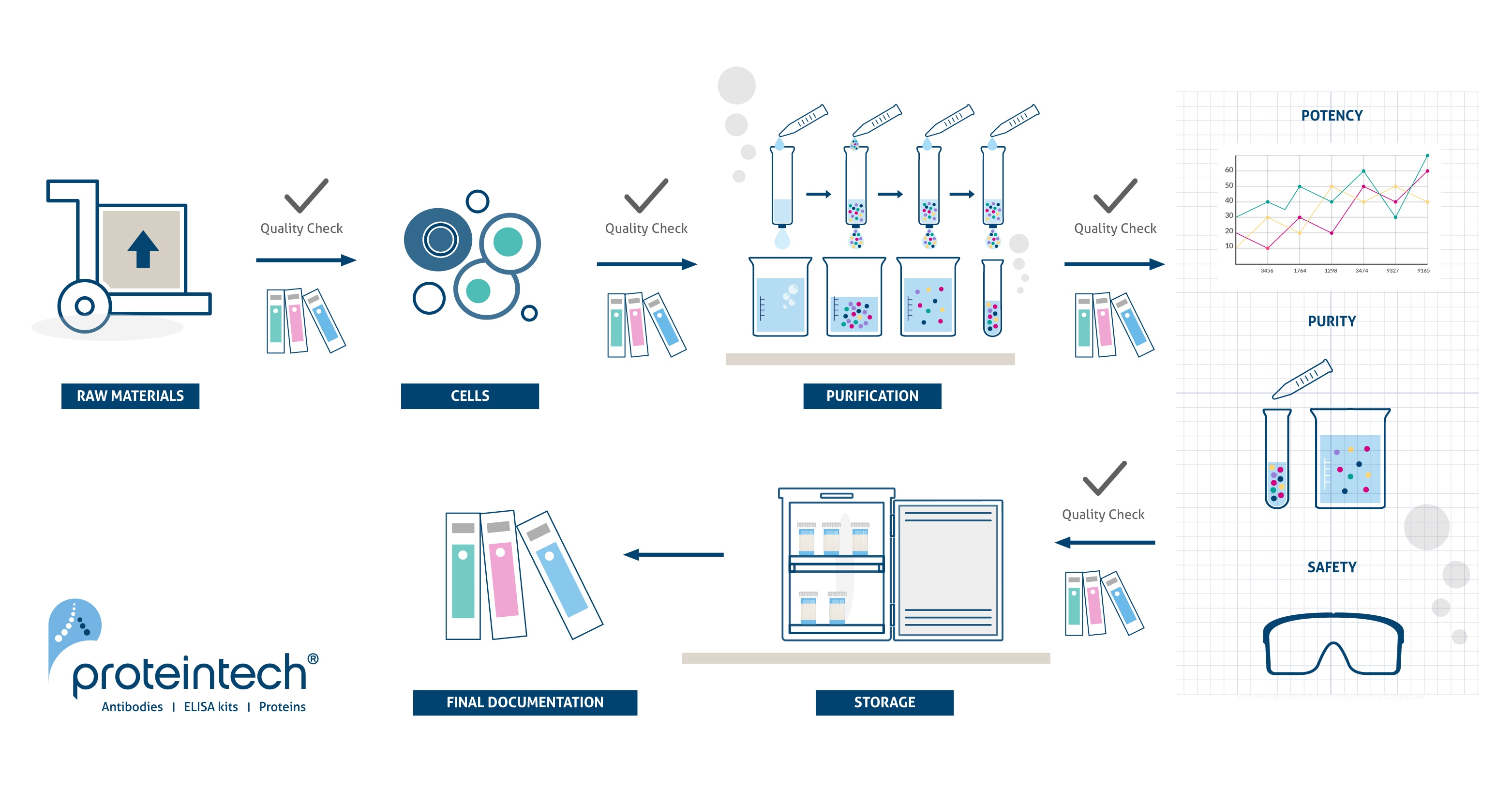
HumanKine®(ヒューマンカイン)サイトカイン&増殖因子が選ばれる理由
- ヒト細胞発現系(HEK293細胞)によって最適化された収率で安定的に産生されたタンパク質です。
- 細胞製品等の製造のための補助材料(Ancillary Materials、AM)として、高い安全性、有効性、ロット間一貫性を提供します。
- 非臨床試験/非臨床研究から臨床試験/臨床研究、商業生産まで対応可能なスケーラビリティを有します。
- 標準研究グレードからcGMPグレードに「シームレス」な移行が可能です。

cGMPグレードサイトカイン&増殖因子
HumanKine®(ヒューマンカイン)は、ヒト細胞発現系(HEK293細胞)で産生された組換えタンパク質です。
| 製品名 | 活性(EC50) | 純度 |
|---|---|---|
| Activin A | 0.5-3.5 ng/mL | >95% |
| BMP-2 | 7.5-37.5 ng/mL | >95% |
| BMP-4 | 1.5-9 ng/mL | >95% |
| BMP-7 | 50-275 ng/mL | >95% |
| Cystatin C | 0.5-2.6 µg/mL | >95% |
| EGF | 0.1-0.6 ng/mL | >95% |
| FGF-4 | 6-30 ng/mL | >95% |
| FGF-7(KGF) | 4-20 ng/mL | >95% |
| FGF-8B | 10-60 ng/mL | >95% |
| FGFbasic-TS | 0.05-0.4 ng/mL | >95% |
| FLT3 Ligand | 0.4-3.0 ng/mL | >95% |
| G-CSF | 0.009-0.05 ng/mL | >95% |
| GM-CSF | 0.08-0.8 ng/mL | >95% |
| HGF | 5-25 ng/mL | >95% |
| HGH | 0.05-0.5 ng/mL | >95% |
| HSA | N/A | >95% |
| IFN alpha 2B | 0.004-0.02 ng/mL | >95% |
| IFN beta | 0.015-0.08 ng/mL | >95% |
| IFN gamma | 0.02-0.14 ng/mL | >95% |
| IGF-I | 2-14 ng/mL | >95% |
| IL-2 | 0.05-0.35 ng/mL | >95% |
| IL-3 | 0.4-2.0 ng/mL | >95% |
| IL-4 | 0.07-0.4 ng/mL | >95% |
| IL-6 | 0.03-0.24 ng/mL | >95% |
| IL-7 | 0.1-14 ng/mL | >95% |
| IL-9 | 0.1-0.6 ng/mL | >95% |
| IL-10 | 0.18-2.0 ng/mL | >95% |
| IL-12 | 0.8-4.0 ng/mL | >95% |
| IL-15 | 0.07-0.37 ng/mL | >95% |
| IL-21 | 0.25-1.25 ng/mL | >95% |
| IL-28A | 0.01-0.06 ng/mL | >95% |
| LIF | 0.045-0.25 ng/mL | >95% |
| M-CSF | 0.7-4.0 ng/mL | >95% |
| Noggin | 1.5-15 ng/mL | >95% |
| OSM | 0.1-1.5 ng/mL | >95% |
| PDGFbb | 0.3-3 ng/mL | >95% |
| SCF | 15-85 ng/mL | >95% |
| TGF beta 1 | 0.01-0.17 ng/mL | >95% |
| TGF beta 2 | 0.018-0.18 ng/mL | >95% |
| TGF beta 3 | 0.15-0.75 ng/mL | >95% |
| Thrombin(Coagulation Factor II) | 1000-5000 units/mg | >95% |
| TNF alpha | 0.002-0.026 ng/mL | >95% |
| TPO | 100-500 ng/mL | >95% |
| Transferrin | 75-400 ng/mL | >95% |
| VEGF165 | 0.3-3.75 ng/mL | >95% |
| Wnt3A | 25-125 ng/mL | >90% |
メールでのお問い合わせ:以下の必要事項をご入力ください。
- 会社名
- 製品名・カタログ番号(Cat No.)
- 証明書名
- お見積りをご希望の場合:ご利用の代理店・担当者(※)
※ 日本国内におけるプロテインテック製品の販売は、「コスモ・バイオ株式会社」を通じて行っております。 「コスモ・バイオ株式会社代理店リスト」をご参照の上、ご指定ください。
Can't find your cGMP protein of interest?
Request for your cGMP protein of interest herecGMP品質

プロテインテックはISO 13485:2016認証を取得しており、cGMPグレードのHumanKine®(ヒューマンカイン)製品は、以下に記載する規格の該当する項目に従って製造および品質検査が実施されています。
- USP Chapter <1043>, Ancillary Materials for Cell, Gene, and Tissue-Engineered Products
- USP Chapter <92>, Growth Factors and Cytokines Used in Cell Therapy Manufacturing
- Ph. Eur. General Chapter 5.2.12, Raw Materials of Biological Origin for the Production of Cell-based and Gene Therapy Medicinal Products
- Sterility testing according to USP <71>.
- Mycoplasma testing according to USP<63>.
- Bacterial endotoxin test according to USP<85>.
cGMP製造プロセス
標準研究グレード vs cGMPグレード
非臨床試験/非臨床研究から臨床試験/臨床研究へ「シームレス」に移行するために、標準研究グレード製品のサイトカインおよび増殖因子は、cGMPグレード製品と同一の製造プロセスを用いて同一条件で製造されています。したがって、2つのグレード間における品質面および性能面の違いは実質的にはありません。プロテインテックの標準研究グレード製品とcGMPグレード製品の大きな違いは、ISO 13484認証およびcGMP準拠の厳格な品質プロセスに準拠しているかどうかです。 cGMPグレード製品の場合、規制に沿った文書化、徹底したQC、トレーサビリティ対応を実施しています。標準研究グレード製品は、cGMPグレード製品と同等の品質を備え、初期の研究開発段階で高い費用対効果を提供します。
品質 |
標準研究グレード |
cGMPグレード |
|---|---|---|
| ISO 13485に基づく品質マネジメントシステム | ✔ | ✔ |
| cGMPガイドラインに準拠 | ✘ | ✔ |
| マスターセルバンク(MCB)の検査・解析 | ✔ | ✔ |
| 全ての製造工程で標準作業手順書(SOP)を作成、遵守 | ✔ | ✔ |
| ロットに関する文書の作成、管理 | ✔ | ✔ |
| 変更管理・逸脱管理 | ✔ | ✔ |
| 製造および品質管理用機器の適格性評価 | ✔ | ✔ |
| 連続バッチ(3バッチ)検査によるプロセスバリデーション | ✘ | ✔ |
| 純度 | > 95% | > 95% |
| 無菌試験 USP<71> | ✘ | ✔ |
| マイコプラズマ否定試験 USP<63> | ✘ | ✔ |
| エンドトキシン試験 USP<85> | < 1.0 EU/µg | < 0.1 EU/µg |
| 加速試験/リアルタイムテストによる安定性検証 | ✔ | ✔ |
| 製品同一性の検証方法 | 2種類の試験 | 2種類の試験 |
| 原料管理・サプライヤー管理 | ✔ | ✔ |
| 試験成績書(CoA)記載の活性値 | EC50 | EC50 /国際単位(IU)で表される比活性(※) (※NIBSC標準品を入手可能な場合のみ) |
| 規制対応サポート:DMF、実地監査、変更通知、品質保証協定等 | ✘ | ✔ (検討中) |
| HumanKine®(ヒューマンカイン)製品一覧 | cGMPグレード製品一覧 |
アニマルフリー&ゼノフリー
HumanKine®(ヒューマンカイン)製品は、品質の一貫性と安全性向上のご要望に応えるべく、厳格な動物成分不含(ACF:Animal component-free)およびゼノフリー(Xeno-free)ポリシーに従い、製造販売されています。プロテインテックは、動物成分不含(ACF)&ゼノフリーポリシーによって以下の点を保証します。
- 最終製品は、動物組織、動物血液を含む体液、およびそれらに由来する成分を含みません。
- すべての原材料は、調達から最終製品に至るまで、アニマルフリーの専用施設で保管および取り扱いされます。
- 最終製品は、ヒト以外の動物由来成分およびヒト以外の動物由来組換え物質を含みません。
ロット間一貫性
細胞製品、遺伝子製品、および組織工学製品の効率的な製造には、使用される補助材料(Ancillary Materials、AM)を含む原料の特性の一貫性が極めて重要となります。HumanKine®(ヒューマンカイン)増殖因子&サイトカインは、製造プロセスが明確に定められており、製品の同一性、純度、生物学的活性等の品質におけるロット間の高い一貫性を保証します。
cGMPグレード BMP-4(カタログ番号:HZ-1045-GMP)

図1. 3つの異なるロットのGMPグレード BMP-4を用いて、ATDC5細胞(マウス軟骨前駆細胞株)におけるアルカリホスファターゼ産生誘導能を測定しました。この試験の測定結果は、1.5~9ng/mLのEC50の値を示しました。さらに還元条件および非還元条件でBMP-4のSDS-PAGEを実施し、各ロットの純度を解析しました。各ロットの生物学的活性と純度は、ほぼ同等の結果を示しました。
cGMPグレード PDGFbb(カタログ番号:HZ-1308-GMP)
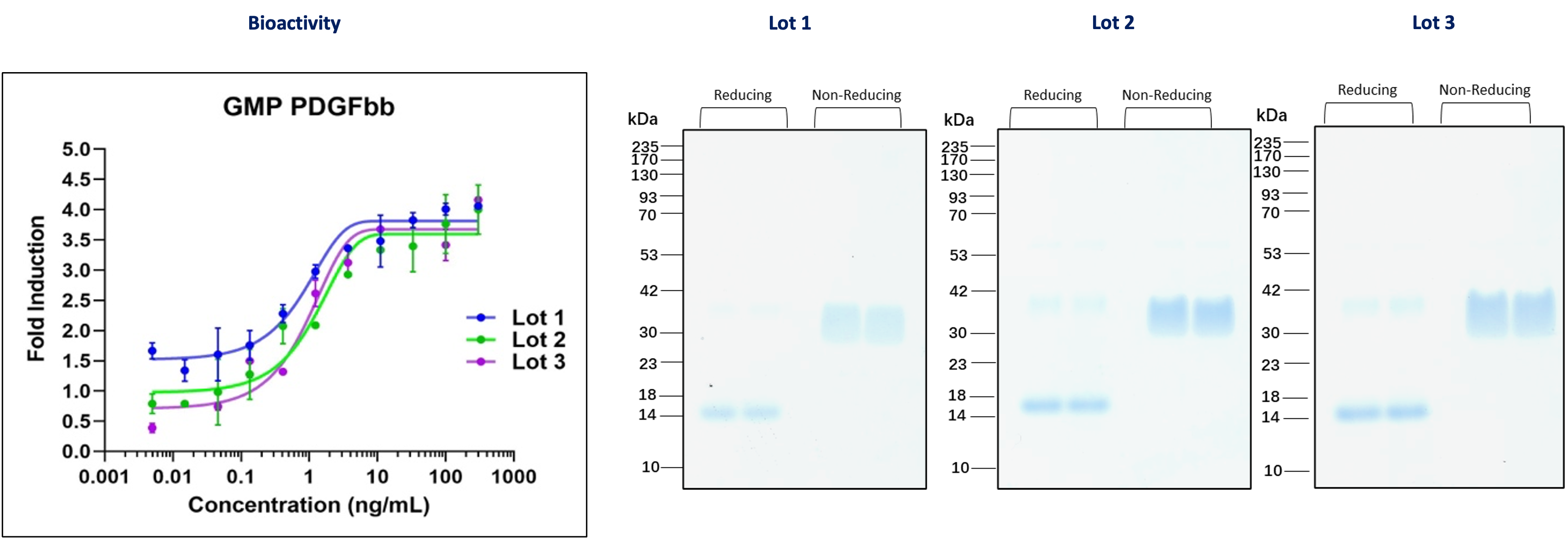
図2. 3つの異なるロットのGMPグレード PDGFbbを用いて、NIH/3T3細胞(マウス線維芽細胞株)における増殖誘導能を測定しました。この試験の測定結果は、0.3~3.0ng/mLのEC50の値を示しました。さらにPDGFbbのSDS-PAGEを実施し、各ロットの純度を解析しました。各ロットの生物学的活性と純度は、ほぼ同等の結果を示しました。これらのデータは、使用した増殖因子の品質の一貫性を示しています。
FAQ
- HumanKine®(ヒューマンカイン)のcGMPグレード製品は、標準研究グレード製品に対してどのような違いがありますか?
cGMPグレード製品は、トレーサビリティ対応や品質試験、品質保証に関する広範な文書化を実施しながら、製造されています。cGMPグレード製品で保証される対応の一部は標準研究グレード製品に適用されませんが、HumanKine®(ヒューマンカイン)の標準研究グレード製品の場合、信頼性の高い品質と初期の研究開発段階での高い費用対効果を提供します。HumanKine®(ヒューマンカイン)の製造プロセスは、cGMPグレード製品と標準研究グレード製品で同一であり、非臨床試験/非臨床研究から臨床試験/臨床研究への「シームレス」な移行を実現し、多くの期間と費用を節約します。
- HumanKine®(ヒューマンカイン)のcGMPグレード製品は、ヒトに投与することができますか?
いいえ、人体へ投与することはできません。HumanKine®(ヒューマンカイン)のGMPグレード製品は、人体に直接投与する剤形の添加剤または医薬品としての使用を目的とする製品ではありません。本製品は、再生医療研究等の分野において細胞製品等を製造する際の補助材料(Ancillary Materials、AM)として、培地添加物成分やその他原料として利用される用途で開発された製品です。そのため、培養や加工後の細胞製品等の最終製品の一部として含まれることは想定されていません。
- HumanKine®(ヒューマンカイン)のcGMPグレード製品の製造施設および工程は、FDA(アメリカ食品医薬品局)または他の規制当局によって認証されていますか?
米国FDA(アメリカ食品医薬品局)は、患者に投与する用途で製造される医薬品等の承認手続きとは異なり、細胞製品の加工等に使用される補助材料(Ancillary Materials、AM)の場合にはその製造施設の査察および認証を実施していません。HumanKine®(ヒューマンカイン)のcGMPグレード製品は、ISO 13485品質マネジメントシステムに基づき、USP(米国薬局方)およびEP(ヨーロッパ薬局方)の推奨事項に準拠して製造され、力価、純度、安全性を保証します。HumanKine®(ヒューマンカイン)を製造する米国のcGMPグレード準拠施設は、要望に応じてエンドユーザーによる査察を受け付けています。
- HumanKine®(ヒューマンカイン)のcGMPグレード製品のリスク分類を教えてください。
HumanKine®(ヒューマンカイン)のcGMPグレード製品は、USP<1043>に基づき、Tier 2に分類されます。本製品は、十分に特性解析された低リスクの製品であり、補助材料(Ancillary Materials、AM)や原料等の用途を目的として、cGMPに準拠して製造されています。
- HumanKine®(ヒューマンカイン)のcGMPグレード製品は、アニマルフリー製品ですか?
はい、HumanKine®(ヒューマンカイン)製品の製造工程および最終製品には、動物由来成分およびヒト組換えタンパク質以外のヒト由来成分は含まれません。
- HumanKine®(ヒューマンカイン)のcGMPグレード製品はどのような包装形態で発送されますか?
本製品は凍結乾燥品であり、ガラスバイアルに入った状態で発送されます。
証明書・文書
各種証明書の発行はお問い合わせください。
- 試験成績書(COA)
- 原産国証明書(COO)
- Sterility certificate
- BSE/TSE statement
- マスターセルバンク(MCB)のウイルス試験証明書
- DMF(Drug Master File)- 申請検討中
メールでのお問い合わせ:以下の必要事項をご入力ください。
- 会社名
- 製品名・カタログ番号(Cat No.)
- 証明書名
- お見積りをご希望の場合:ご利用の代理店・担当者(※)
※ 日本国内におけるプロテインテック製品の販売は、「コスモ・バイオ株式会社」を通じて行っております。 「コスモ・バイオ株式会社代理店リスト」をご参照の上、ご指定ください。
プロテインテックのcGMP準拠施設(米国イリノイ州ローズモント)
