神経変性疾患のバイオマーカー
神経変性疾患を正確かつ早期に診断するためには、疾患との高い関連性を示す体液バイオマーカーが必要とされます。本稿では、現在のバイオマーカーや将来的に利用できる可能性のある有望なバイオマーカーについて解説します。
Nerea Gómez de San José著(ウルム大学病院Institute of Experimental Neurology博士課程在籍)
神経変性疾患は、神経細胞の構造崩壊や機能喪失を特徴とする一群の進行性疾患であり、中枢神経系障害を生じさせます。主な神経変性疾患としてアルツハイマー病(AD:Alzheimer’s disease)や前頭側頭葉変性症(FTLD:Frontotemporal lobar degeneration)、レビー小体型認知症(LBD:Lewy body dementia)等が挙げられます。これらの神経変性疾患は、神経炎症や「プロテイノパチー(プロテオパチー)」として知られるミスフォールディングタンパク質の蓄積を特徴とします(1)。特定の脳領域の変質は、行動障害やパーキンソニズム等の様々な臨床症状の原因となります。神経変性疾患を発症する主なリスク要因は加齢です(2)。平均余命が延びているため、変性疾患の有病率は今後数十年で大幅に上昇すると予測されています(3)。そのため、神経変性疾患に関連したバイオマーカーの必要性に迫られています。有用なバイオマーカーの開発により、疾患の早期かつ正確な診断、治療戦略の改善、有効性の高い疾患修飾療薬の開発のための臨床試験の補助につなげることが望まれます(4)。近年の研究手法の顕著な進歩によって、脳脊髄液(CSF)や血液に含まれる体液バイオマーカー/バイオマーカー候補が同定されています。
神経変性疾患の脳脊髄液(CSF)バイオマーカー
脳脊髄液(CSF)は、中枢神経系を取り囲む液体であり、神経変性疾患のバイオマーカー探索に理想的サンプルです。脳脊髄液(CSF)は脳や脊髄の細胞外空間と直接的に接触しているため、神経変性疾患が生じた際の生化学的変化を反映していると想定されます。脳脊髄液バイオマーカーの中でも、アルツハイマー病(AD)のバイオマーカー研究が最も進んでおり、いくつかのバイオマーカーは臨床検査等に導入されています。それらはコア・バイオマーカーとも呼ばれ、アミロイド-β(Aβ)、リン酸化タウタンパク質(p-tau181:181番目のスレオニン残基がリン酸化されたタウタンパク質)、総タウタンパク質(t-tau)は脳脊髄液(CSF)バイオマーカーとして有用性が確立しています。それぞれがアミロイド病変、タウ病変、総合的な神経変性疾患等のマーカーとして機能し、新規アルツハイマー治療のモニタリングを容易にする可能性があります(5)。しかし、症状を発症する前の段階のアルツハイマー病(AD)診断に利用できるバイオマーカーや、認知機能低下のようなその他の臨床症状をモニタリングできるバイオマーカーはいまだに存在しません。
また、前述したアルツハイマー病(AD)のバイオマーカー以外に、前頭側頭葉変性症(FTLD)やレビー小体型認知症(LBD)を診断できるバイオマーカーは現在のところ十分に確立されていません(6、7)。前頭側頭葉変性症(FTLD)は様々な表現型・遺伝的背景・病態を有する神経変性疾患であるため(8)、バイオマーカーを同定することは著しく困難です。また、レビー小体型認知症(LBD)患者の脳において凝集が認められるα-シヌクレイン(Alpha-Synuclein)は、患者の脳脊髄液(CSF)中濃度が低下することが判明しています。しかし、α-シヌクレイン濃度は変動が認められることが多く、対照群と十分な差を示さない場合があるため、臨床検査等の日常的なマーカー測定には適さない可能性があります(9)。ニューロフィラメント軽鎖(NfL:Neurofilament light)は、総合的な神経変性疾患のバイオマーカーや軸索障害のバイオマーカーとして使用できる可能性が示唆されています。しかし、NfLは筋萎縮性側索硬化症(ALS:Amyotrophic lateral sclerosis)、前頭側頭型認知症(FTLD)、非定型パーキンソニズム等の複数疾患の患者の脳脊髄液(CSF)中における濃度上昇が示されており(4、10)、鑑別診断用のバイオマーカーとして使用できる可能性は低いと考えられます。神経変性疾患において生じるその他の病態変化を反映したバイオマーカーには、シナプスの減少/機能低下(マーカー:ニューログラニン、SNAP-25、GAP-43、NPTX)やグリア細胞活性化(マーカー:GFAP)により変化するマーカー候補が挙げられ、研究が進められています(4、11、12)。
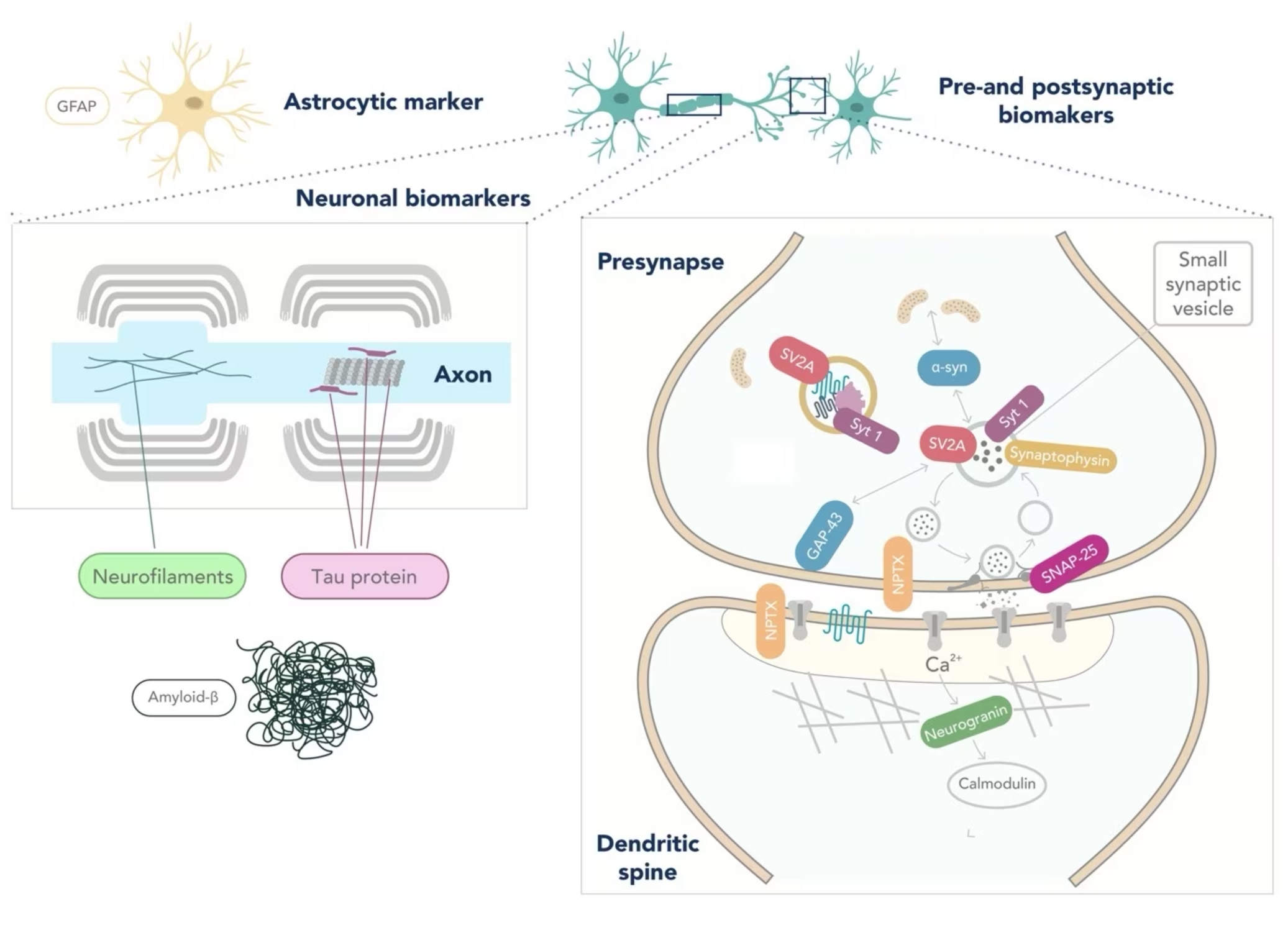
図:一般的な神経変性疾患体液マーカーの発現部位。Camporesi et al, 2020(12)より引用。
神経変性疾患の血液バイオマーカー
脳脊髄液(CSF)には上述した利点がある一方で、侵襲的な痛みを伴う方法で採取されるため、高い頻度でサンプリングを実施してバイオマーカーを測定することが難しい試料です。そこで、集団スクリーニングを実施可能な血液バイオマーカーの開発に関心が集まっています。しかし、血液中の脳由来タンパク質の解析は困難なプロセスです。脳由来のタンパク質や物質は、血液脳関門(BBB)を通過し、リンパ系を介して血流にアクセスしなければなりません。血中に到達したとしても、血漿の複雑な組成から脳由来タンパク質や物質を高い正確性で検出しなければならないことが課題となります。さらに、末梢器官でも脳バイオマーカーは発現しているため、中枢神経系の異常に起因する変化と末梢器官に起因する変化の区別を困難にします。しかしながら、Simoa®(高感度ELISA装置)、Ella™(全自動ELISA装置)、電気化学発光法(ECL:Electrochemiluminescence)等の高感度検出法が発展してきたことにより、アミロイド-β病理や総合的な神経変性疾患をスクリーニングするためのバイオマーカー候補としてアミロイド-β、p-tau181、NfL等の血中バイオマーカーを検出できるようになっています(13)。またGFAP(14)やβ-シヌクレイン(15)等は、潜在的な血液バイオマーカーになり得る可能性が示唆されています。こられは神経変性疾患の病態メカニズムの解明や疾患の早期診断に役立つ可能性があります。
バイオマーカーの測定手法
新規バイオマーカー候補の探索には主に2種類のアプローチが用いられます。それらは、(1)疾患の病態メカニズムに関与する既知のタンパク質を調査するアプローチ、および(2)大規模なタンパク質セットを客観的に解析する網羅的解析を利用して新規バイオマーカーを同定するアプローチです。これらの探索手法には、幅広く使用される質量分析法(MS)や、新たに登場したマルチプレックス抗体を基にした手法(例:Proximity extension assay(PEA))が含まれます(16)。新規のバイオマーカー候補が特定された場合、完全な検証のためにバイオマーカー候補物質を対象にした定量的手法が必要になります。検証実験には、特定のタンパク質を高精度に検出する質量分析法(ターゲット分析)や、ELISA法のような古典的な免疫アッセイが使用されます(16)。ELISA法は、臨床検査等で日常的に実施しやすい手法である一方、極めて高感度かつ特異性の高い抗体ペアが求められます。その他に、現在のところReal-time quaking-induced conversion(RT-QuIC)法という手法が神経変性疾患患者の試料からα-シヌクレイン等の異常凝集性タンパク質を検出するために使用されており、RT-QuIC法はその他のタンパク質の診断にも利用できる可能性があります(17)。
課題と今後の展望
過去数十年に渡るバイオマーカー探索の目覚ましい進歩と、いくつかのアルツハイマー病(AD)診断用バイオマーカーの確立にもかかわらず、アルツハイマー病(AD)以外の神経変性疾患のバイオマーカーの開発は著しく遅れています。バイオマーカー研究分野でのさらなる発展には、依然としていくつかの課題に取り組む必要があります。新規バイオマーカー候補の同定を妨げている主要な障壁の1つは、神経変性疾患の根底にある病態生理学的メカニズムの解明に限界がある点です。すなわち、多くの疾患では多様なメカニズム・遺伝的背景が認められているため、その複雑性と不均一性は信頼性の高い診断のための単一バイオマーカー候補の発見を一層困難にしています。1種類のバイオマーカーによる診断が困難な場合は、複数のバイオマーカーパネルが必要になる可能性があります。さらに、再現性の高い結果を保証するには、適切に採取・管理された、背景・特性の明瞭な患者試料、高品質な試薬類、リファレンス物質の確保、アッセイバリデーションの適切な実施が必須です(18)。
近年開発された超高感度手法や機械学習アルゴリズムは、血液バイオマーカーの発見や臨床応用につながる可能性があり、将来的な活用が期待されています。今後のバイオマーカーの開発・研究は、疾患の診断や患者の治療法を向上させ、より進んだ個別化医療(Personalized healthcare)を実現するために重要な取り組みです。
神経変性疾患関連抗体・バイオマーカー
ELISAキット
参考文献
- D M Wilson Ⅲ、I Dewachter, et al. Hallmarks of neurodegenerative diseases. Cell. 2023 Feb 16;186(4):693-714.
- Y Hou, D L Croteau, V A Bohr, et al. Ageing as a risk factor for neurodegenerative disease. Nat Rev Neurol. 2019 Oct;15(10):565-581.
- M Prince, A Wimo, M Guerchet, G-C Ali, Y T Wu, M Prina. World Alzheimer Report 2015: The global impact of dementia: An analysis of prevalence, incidence, cost and trends. Alzheimer’s Disease International (ADI), London. 2015 Sep 21.(alzint.org)
- O Hansson. Biomarkers for neurodegenerative diseases. Nat Med. 2021 Jun;27(6):954-963.
- J Simrén, Elmgren, K Blennow, H Zetterberg. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 2023:112:249-281.
- I G McKeith, et al. Diagnosis and management of dementia with Lewy bodies: Fourth consensus report of the DLB Consortium. Neurology. 2017 Jul 4;89(1):88-100.
- M Del Campo. New developments of biofluid-based biomarkers for routine diagnosis and disease trajectories in frontotemporal dementia. Alzheimers Dement. 2022 Nov;18(11):2292-2307.
- J Bang, S Spina, B L Miller. Frontotemporal dementia. Lancet. 2015 Oct 24;386(10004):1672-82.
- L Parnetti, L Gaetani, et al. CSF and blood biomarkers for Parkinson's disease. Lancet Neurol. 2019 Jun;18(6):573-586.
- N J. Ashton, O Hansson, et al. A multicentre validation study of the diagnostic value of plasma neurofilament light. Nat Commun. 2021 Jun 7;12(1):3400.
- A Abdelhak, H Tumani. Blood GFAP as an emerging biomarker in brain and spinal cord disorders. Nat Rev Neurol. 2022 Mar;18(3):158-172.
- E Camporesi, J Nilsson, N J Ashton, et al. Fluid Biomarkers for Synaptic Dysfunction and Loss. Biomark Insights. 2020 Aug 21:15:1177271920950319.
- N J Ashton, D Aarsland, et al. An update on blood-based biomarkers for non-Alzheimer neurodegenerative disorders. Nat Rev Neurol. 2020 May;16(5):265-284.
- C Heller, J D Rohrer, et al. Plasma glial fibrillary acidic protein is raised in progranulin-associated frontotemporal dementia. J Neurol Neurosurg Psychiatry. 2020 Mar;91(3):263-270.
- P Oeckl, M Otto, O Hansson, et al. Higher plasma β-synuclein indicates early synaptic degeneration in Alzheimer's disease. Alzheimers Dement. 2023 Nov;19(11):5095-5102.
- K Waury, S Abeln, et al. Bioinformatics tools and data resources for assay development of fluid protein biomarkers. Biomark Res. 2022 Nov 15;10(1):83.
- B R. Groveman, C D. Orrù, D Galasko, B Caughey, et al. Rapid and ultra-sensitive quantitation of disease-associated α-synuclein seeds in brain and cerebrospinal fluid by αSyn RT-QuIC. Acta Neuropathol Commun. 2018 Feb 9;6(1):7.
- A J van Gool, A Ussi, et al. Bridging the translational innovation gap through good biomarker practice. Nat Rev Drug Discov. 2017 Sep;16(9):587-588.


