ELISA実験を最適化する方法
ELISAで良好な結果を得るための技術的ヒントについて解説します。
目次 |
ELISAとは?
ELISA法(enzyme-linked immunosorbent assay)は、現在利用可能な技術の中でも、最も感度と再現性の高い技術の1つです。ELISAによるアッセイは迅速かつシンプルな手順で、自動化も容易です。他のアッセイと同様に、ELISAでの再現性と信頼性のある結果は、適切な手技と細かい点への配慮に委ねられます。
プロテインテックの解析アプリケーション:ELISA
ELISAの手法の分類
- 直接法:抗原をELISAプレート上に固定し、直接標識した一次抗体で検出を行います(図1A)
- 間接法:抗原をELISAプレート上に固定し、抗原と結合する一次抗体を添加後、標識した二次抗体で検出を行います(図1B)
- サンドイッチ法:2種類の一次抗体(捕捉(キャプチャー)抗体および検出抗体)で抗原を挟み込み、「サンドイッチ」の状態を形成し、標識した二次抗体で抗原抗体複合体の検出を行います(図1C)
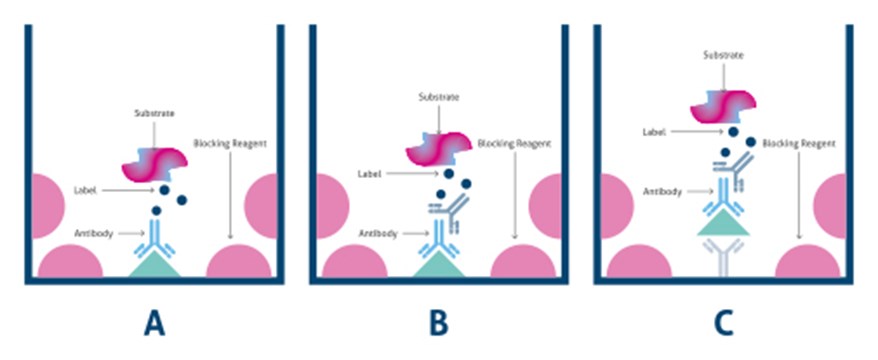
図1. ELISAの種類:A)直接法、B)間接法、C)サンドイッチ法
ELISAキットのマッチド抗体ペア(Matched antibody pair)
マッチド抗体ペアとは、同一のタンパク質の異なるエピトープを認識することが判明している抗体の組み合わせを指します。マッチド抗体ペアはサンドイッチ法において単一の抗原の捕捉および認識に使用することが可能です。モノクローナル抗体同士、ポリクローナル抗体同士、あるいは両方の組み合わせを、ELISAアッセイに使用することができます。
モノクローナル抗体は、すべての種類のELISA法において抗体を用いる全ステップで使用することが可能です。一般的に、モノクローナル抗体同士をサンドイッチ法のマッチド抗体ペアに使用することが多くある一方で、シグナルを増強したり複雑な組成の溶液中から抗原を捕捉する可能性を高めるために、モノクローナル抗体と共にポリクローナル抗体を捕捉抗体(キャプチャー抗体)、または検出抗体として組み合わせて使用することも可能です。
ポリクローナル抗体は、様々なエピトープを認識する不均一な抗体群であるため、抗原を検出するパワフルなツールとなり、多くの場合、モノクローナル抗体よりも高いシグナルが得られる傾向にあります。しかし、ポリクローナル抗体は目的タンパク質と高い相同性や類似した構造を有するタンパク質を含む1種類以上のエピトープを認識する場合があり、非特異的シグナルが高くなるおそれがあります。この問題を軽減する方法の1つに、アフィニティ精製したポリクローナル抗体や交差吸着処理したポリクローナル抗体を使用するという手段があります。アッセイの感度を向上させるために、ELISAの検出方法を直接法からポリクローナル抗体を用いた間接法に切り替えることも可能です。
ELISA用サンプル
ELISAでは、様々なサンプル(検体)を測定することが可能です。アッセイ条件は、サンプルの複雑性と抗原の予測される存在量によって異なります。
定量結果の正確性を担保するために、すべてのサンプルを既知濃度の標準溶液と共に2連または3連で実施することが重要です。
希釈倍率を変えた複数のサンプルを測定し、測定結果が標準曲線の直線領域の範囲内に収まることを確認すると良いでしょう。目的物質の濃度が高いサンプルは実際よりも低い値が算出されてしまい、極端に希釈したサンプルは実際よりも高い値が算出されてしまうおそれがあります。
ELISAのブロッキングステップおよび洗浄ステップ
多くの場合、マルチウェルプレート表面に検出抗体が非特異的に結合することを防ぐために、ブロッキングの操作が必要となります。プレートが完全にブロッキングされると、非特異的シグナルが低減するためアッセイ感度が向上します。
信頼性の高いELISAの結果を得るためには、徹底的な洗浄操作が非常に重要となります。吸引用チップをゆっくりと底まで下げて、すべてのウェルから液体を完全に吸引することが重要です。操作時は、ウェルの底面や内側をこすらないように注意します。洗浄完了後はプレートを裏返し、吸収性ティッシュや紙ウエスに叩いて押し付けるようにして残存する液体を完全に除去することを推奨します。
ELISA実験の最適化
各項目を別々に説明していますが、多くの場合、チェッカーボードタイトレーション法(checkerboard titration method)を実施することにより2種類の項目を同時に最適化することが可能です。
1)キャプチャー抗体の濃度
- キャプチャー抗体の濃度が異なるコーティングバッファーを調製します。
2)ブロッキングバッファー
- 複数のブロッキング溶液を用意します。既製の調整済みのブロッキング溶液でない場合(例:BSA等の単一タンパク質を用いる場合)は、異なる濃度の溶液を調製して検討を実施します。
3)スタンダード用希釈液
- スタンダード(標準タンパク質)用希釈溶液は、できる限りサンプルマトリックスに近い組成の溶媒を検討します。
- マトリックスの組成を正確に再現できない場合は、複数の標準タンパク質用希釈溶液を実際に測定し、標準曲線(standard curve、検量線)の希釈系列の直線性を確認します。標準曲線の直線性が認められない場合は、別の希釈溶液を選択した方が良いでしょう。
- サンプルの直線性が乏しい場合、サンプルマトリックスとスタンダード用希釈溶液間のバランスが崩れている可能性があります。このような場合、添加回収試験や希釈直線性試験を実施することをおすすめします。
4)サンプル濃度
- 基質の検出限界を考慮して、異なる濃度のサンプル溶液を調製します。生体試料であるサンプルマトリックスがシグナルを阻害または増強していないことを確認するため、添加回収試験および希釈直線性試験を実施する必要があります。
5)検出抗体濃度
- 異なる濃度の検出抗体を調製して最適な濃度を検討します。
6)標識酵素濃度
- ELISAキットに記載されている添加基質濃度を参考に、異なる濃度の酵素標識物質/酵素標識抗体を調製して最適な濃度を検討します。
7)シグナル検出
- サンプル中の抗原量およびプレートリーダーの性能に基づき使用する基質を選択します。
- 抗原を明瞭に検出できる場合、その基質は適切であったといえます。
- 抗原を検出できない場合(閾値以下の場合)は、より感度が高い別の基質を選択します。
一般的なELISAのトラブル
1)シグナルが弱い、またはシグナルが認められない
- アッセイを開始する前に、すべての試薬を15~20分間室温におき、ELISA測定を実施します。
- 試薬類の保管方法を間違えている:キットの取扱説明書に記載されている保管条件を再確認してください。ほとんどのELISAキットは2~8℃またはそれ以下の温度条件での保管が必要です。
- 試薬の調製法や添加する順序を間違えている:プロトコールをチェックし、試薬が正確に希釈されていること、適切な順序で添加されていることを確認します。
- 蛍光試薬を過度に露光する:蛍光ELISA法の場合、強い光は、フルオロフォア(蛍光色素・蛍光体)が分解されることによる光退色の原因となります。光からのフルオロフォアの保護は、アッセイの最後に効率的なシグナルを生成するために非常に重要となります。
- 試薬類の最適化が不十分:アッセイに使用する試薬類のいずれか1つの試薬濃度が不適切である場合、全体のシグナルが弱くなります。
- 試薬の変質:使用した試薬の中に劣化している、または汚染(コンタミネーション)を起こしているおそれがあるものがあります。このような場合は、新たな試薬に取り換える必要があります。
- 抗体の組み合わせが悪い、またはターゲットに対する親和性がない:使用した抗体が抗原に効率的に結合しない、または抗体の組み合わせが不適切で機能を発揮していないおそれがあります。このような場合、代替の抗体を使用して別途評価を実施します。
- 検出系の測定条件が不適切である:検出系(基質)の感度が不十分である、または用意した標準曲線が実際のサンプル濃度に対して不適切である可能性があります。サンプル中の目的物質の濃度が高くなるように希釈倍率を調整する、またはより高い感度の基質を選択する等の対策が必要となる可能性があります。
2)バックグラウンドが高くなる
- 洗浄(washing)やブロッキング(blocking)の操作が不十分/ブロッキング剤が不適切/標識酵素添加量が不適切である:通常、洗浄やブロッキングの操作が不十分だった場合や、サンプル中の成分がブロッキングバッファーと交差反応を示す場合、または標識酵素を過剰に添加した場合等に、バックグラウンドシグナルが高くなります。
- 特異的なシグナルを得られる酵素量とバックグラウンドシグナルが生じてしまう酵素量のバランスが重要です。良好なシグナルを得られる酵素量に調節するためには、酵素標識物質、抗体、ブロッキングバッファーを最適化することが最も効果的です。
3)標準曲線の直線性が認められない
- 直線性の範囲が狭い標準曲線の場合、サンプルの測定値が直線性を示す検量線の範囲内におさまれば、得られるサンプル濃度は正確な濃度であるとみなされます。
- 標準曲線の直線性は良好であっても測定値にばらつきがある場合や、室内再現性が悪い場合(CV値や標準誤差の値で判断します)、ピペッティング操作の技術が未熟である、あるいは実験者間のピペッティング操作にばらつきがあるといった技術的な問題がある可能性があります。
すべてのサンプルおよび標準曲線用溶液は、少なくとも2連または3連で測定し、ばらつきを抑え、正確さと精度の良好な測定値を得られるよう努めましょう。
4)過剰に高いシグナル
- 洗浄操作が不十分:この問題を回避するには、適切な洗浄手順を実施します(例:各洗浄操作の最後に、プレートを吸収性ティッシや紙ウエスに等の上に逆さまに置いて残っていた溶液を吸い取り、必要に応じて強く叩いて押し付けるようにして、残存する液体を除去します)。
- インキュベーション時間が長すぎる:極端にインキュベーション時間を長く取ると、ELISAのシグナルが過度に大きくなってしまいます。必ず、取扱説明書等に記載されているインキュベーション時間に従ってください。
- コンタミネーション:コンタミネーションを防ぐためには、プレートシールを使用します。各操作でプレートシールをはがすたびに、新しいプレートシールを使用します。こうすることで、ウェル同士のコンタミネーションを防ぎます。


