IFイメージング:広視野顕微鏡と共焦点顕微鏡
研究課題を最も効率的に解決するために
はじめに
免疫蛍光染色(IF)は、細胞中の目的タンパク質を可視化するために使用される技術です。IFでは、蛍光色素が直接標識された一次抗体、または標的タンパク質に対する未標識抗体と蛍光色素を標識した二次抗体の両方を使用して、目的タンパク質を可視化します。
蛍光顕微鏡法は、蛍光プローブ、蛍光色素、蛍光タンパク質(フルオロフォア)を使用して試料を標識し、画像化するイメージング技術です。イメージングは、蛍光分子の特異的な誘起原理に基づいており、特定の波長の光がフルオロフォアに吸収されると、その波長よりも長い波長の蛍光が発せられます。
現在使用されている蛍光顕微鏡のほとんどは、照射誘起光と検出放射光が同一の光路(対物レンズ)を通過する、落射型蛍光顕微鏡です。こうした顕微鏡は、生物学の分野で幅広く使用されており、共焦点顕微鏡等の高度な顕微鏡の開発設計の基礎となっています(図1)。
広視野顕微鏡および共焦点顕微鏡
広視野顕微鏡(図1A)の場合、標識された試料から放射した蛍光は、励起光の照射に使用された同一の対物レンズを通過して検出器で結像します。ダイクロイックミラーが波長特異的フィルターとして機能し、誘起光を試料側に反射し、試料から放射された蛍光は、誘起光よりも波長の長い蛍光を接眼レンズや検出器の方向に透過します。
共焦点顕微鏡(図1B)の場合、光はレーザーによって放出されます。特定の波長がピンホールを通過して、ダイクロイックミラーによって試料側へ反射します。ピンホールは、焦点面の光のみを検出器に到達させます。この効果により、焦点面以外の光を低減し、画質を向上します(図2)。誘起状態になったフルオロフォアが発する二次蛍光は、ダイクロイックミラーを通過して光電子倍増管(PTM)検出器のピンホールの位置で共焦点の形で焦点を結びます。
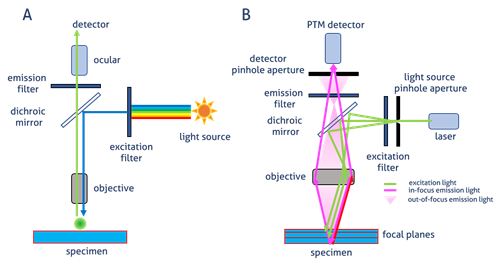
図1. A)広視野落射型蛍光顕微鏡における画像生成 B)共焦点顕微鏡における画像生成
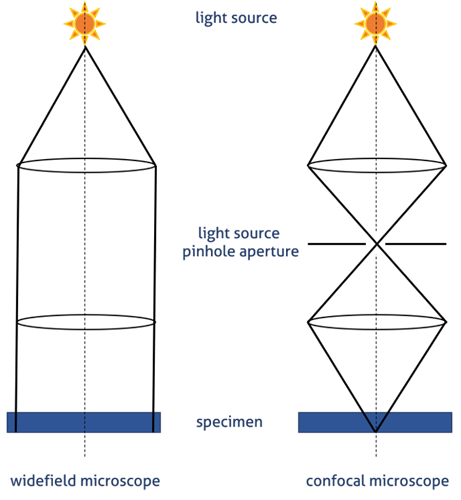
図2. 広視野顕微鏡および共焦点顕微鏡における光路—ピンホール原理の模式図
広視野顕微鏡と共焦点顕微鏡:長所と短所
広視野顕微鏡の主な長所は、迅速に画像が得られ、接眼レンズで直接観察できることです。また、共焦点顕微鏡に比べて、メンテナンスコストがかかりません。
一方、広視野顕微鏡は、バックグラウンドが高くなるリスクがあります。また、チャンネル間のブリードスルー(蛍光の漏れ込み:複数の蛍光色素の蛍光スペクトルが重複している場合に生じます)のリスクもあります。また、使用しているフィルターセットによっては使用できない誘起波長帯も存在するといった制限があります。
共焦点顕微鏡を使用することで、解像度の高い画像を得ることが可能で、S/N比も向上します。また、焦点面以外からの光散乱による画像のにじみを簡単に除去することができます。共焦点顕微鏡は、誘起光と観測光の波長を決める際に自由度が高いため、チャンネル間のブリードスルーを低減します。倍率は、コンピューター上で調節可能で、広範囲の試料全体をスティッチングすることも可能です。共焦点顕微鏡を使用すると、効率的にZ軸のスキャン(走査)ができるため、厚みのある試料を鮮明に観察し、3Dで再構成することができます。
しかし、共焦点顕微鏡を使用すると(走査速度にもよりますが)時間がかかり、広視野顕微鏡に比べて画像取得手順が複雑です。また、共焦点イメージングはPMT(光電子倍増管)検出器によるデジタル画像しか得ることができません(接眼レンズを介した蛍光観察は広視野顕微鏡で行います)。
研究に最適な顕微鏡は?
品質、速さ、使いやすさと、費用の兼ね合いを考えると、広視野蛍光顕微鏡が最も妥当で、大抵の用途に使用できる十分な機能を備えています。したがって、プロトコールの初期スクリーニングや生細胞イメージングのアプリケーションを実施するには完璧なツールであり、共焦点顕微鏡を使用してスキャンするよりも、撮影に要する時間が少ない点が長所です(個々の染色実験におけるS/N比が十分に大きいことが前提となります)。
はじめに広視野顕微鏡を使用して、共焦点顕微鏡に供する試料の染色がうまくいっているか検証することを習慣づけると良いでしょう。例えば、細胞内局在、タンパク質間相互作用の研究、共局在、厚みのある組織の3Dイメージング、試料表面を広い範囲で観察する(フィールド間のスティッチング)場合は共焦点顕微鏡を使用した方が良いでしょう。多重染色イメージング、タイムラプスイメージング、蛍光寿命イメージング(FLIM)、光褪色後蛍光回復法(FRAP)等も共焦点顕微鏡で実施可能です。
 |
|
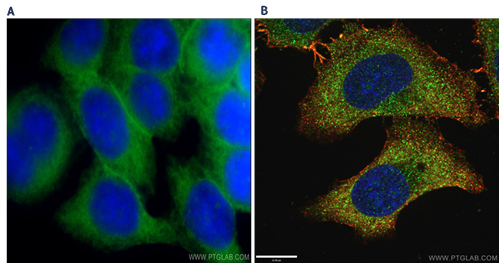
図3. A)GLUT1(SLC2A1)抗体(カタログ番号:21829-1-AP、希釈倍率1:50)とAlexa Fluor 488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体を使用して、広視野顕微鏡で観察したHela細胞の免疫蛍光染色解析像。B)LAMP1抗体(カタログ番号:55273-1-AP、希釈倍率1:50)とAlexa Fluor 488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体を使用して、共焦点顕微鏡で観察したHepG2細胞の免疫蛍光染色解析像(-20℃エタノールで細胞を固定。核の対比染色にDAPIを使用した)。 |
顕微鏡のセットアップと適切な試料のコントロール
IFイメージングには、顕微鏡を適切にセットアップし、適切なコントロール群を設定することが非常に重要となります。重要なポイントのいくつかを以下にまとめました。
—多重染色した試料を複数のチャンネルで観察する場合、チャンネルのブリードスルーを軽減するために、誘起波長領域と蛍光波長領域が狭いフルオロフォアを選択してください。
—コントロール試料と測定試料は同一の設定を適用して並べて画像化し、バックグラウンドシグナルや偽陽性のシグナルを取り違えることのないようにします。
—各実験に、以下のコントロール実験を加えてください:
- ノックアウトした細胞、組織、細胞株等の陰性コントロール、および陽性コントロール。
- 二次抗体のみで試料を染色する。
- 多重染色をする場合、各抗体を個別に試験しておく。
個別の実験や、効率的な方法で解明したい研究テーマの内容が何かによって、選択する顕微鏡は異なります。


