細胞内フローサイトメトリー染色プロトコール
フローサイトメトリー向け細胞内染色の様々なアプローチを、固定と透過処理に関する本稿「do-it-yourself」ガイドで理解しましょう。
フローサイトメトリーは、不均一な集団中の細胞群を同定する非常に有効な技術で、抗体を使用して関連する同定マーカーを測定します。細胞外タンパク質の検出は生細胞で実施することができますが、細胞内タンパク質を検出するためには異なる手順が必要になります。最初に、細胞内のタンパク質を固定して、透過処理後にタンパク質が拡散できないようにする必要があります。続いて、細胞膜を透過処理して抗体が細胞内の目的タンパク質と反応できるようにします。
様々な固定と透過処理の方法があり「fix and perm(固定・透過処理)」として通例知られています。そうした方法の中には、調製済みのbufferやわかりやすい説明書が付属する人気の市販のキット等も含まれます。しかしながら、固定・透過処理は、どこでも入手可能な試薬を使用して簡単に実施することができます。コストを節約して、目的に応じた組成の緩衝液を微調整できます。特定の組織試料や細胞種によっては特定の溶液が適している場合があり、最適の結果を得るためには細胞外抗原と細胞内抗原で異なる手法を必要とする場合があることに注意してください。そのため、抗体メーカーのプロトコールや注意書きに従うことが推奨されます。
固定と透過処理を実施する前に、まずは試料(組織ホモジネートや細胞株)を単一細胞懸濁液に調製してください。詳細は「フローサイトメトリーの完全ガイド[PDF](言語:英語)」を参照してください。固定、透過、染色は、個々のFlow Tubes内で実施するか、代替法として固定・透過を大きなバッチで実施してから分注して染色することも可能です。最も一般的に使用されている固定剤は4%パラホルムアルデヒド(PFA:paraformaldehyde)で、その他の一般的な溶剤には、有機溶媒のメタノール、アセトン、エタノールがあります。場合によっては、他の固定剤によるエピトープの破壊を防ぐために亜鉛含有固定液を使用します(PMID:24735454参照)。固定操作は氷冷した溶液で実施するのが望ましく(固定処理は発熱性のプロセスであるため)、すべての細胞に固定剤が完全に浸透するように試料を穏やかにボルテックスしてください(細胞が凝集しないようにしてください)。固定処理後は固定剤を完全に洗い流してください。こうすることでタンパク質の過剰な架橋形成を回避します(架橋により自家蛍光が増加します)。また、残っている固定剤によって抗体と非特異的ターゲットが架橋するのを防ぎます。
固定処理が終了したら、細胞の種類や目的タンパク質に応じて適切な溶液で細胞の透過処理を実施します。ほとんどの場合、メタノールが透過処理に適していて、細胞質ゾル、オルガネラ、核を透過させる強い作用があります。メタノールが実験目的に適していない場合、架橋・固定操作の後にTriton Xのような強い作用のある界面活性剤を使用します。サポニンは作用の弱い界面活性剤であり、ある種のエピトープの天然構造をより保護することができる一方、オルガネラや核膜を透過できるほど強い作用はなく、抗体のそれらの抗原への到達性を低下させるおそれがあります。固定処理と透過処理が終了したら、続けて抗体染色の操作を実施します。
PFA等の架橋系固定剤は、リン酸化等の翻訳後修飾を保護するため、細胞内シグナル伝達の研究に適している場合があります。一方、アルコール系固定剤では、こうしたタンパク質の検出が不十分となる場合もあります。しかし、リン酸化STAT等のいくつかのタンパク質の中には、従来のアルデヒド‐界面活性剤系固定・透過処理を実施しても未だ検出が難しいものもあります。こうした試料の場合、氷冷メタノールを使用するとエピトープ等を「露出させる」こともできます(PMID: 16080188参照)。まずは、抗体メーカーの製品ガイドに従い、使用する抗体と標的タンパク質に最も適しているとされる固定剤と透過剤を使用して、抗体の検証工程で最適な組み合わせを確認することを推奨します。フローサイトメトリーに使用する抗体を選択する際は、メーカーでの検証にどの固定剤と透過剤が使用されたかについて明記されている製品を探してください。プロテインテックでは、各製品の個別プロトコール内に使用した試薬を記載しています。
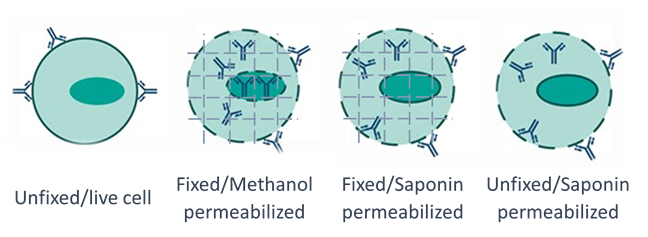
図1. 抗体が細胞内標的タンパク質と結合するための異なる固定法と透過法の模式図。
細胞内タンパク質/細胞外タンパク質の染色
特定の研究課題に答えるために、細胞表面タンパク質と細胞質タンパク質をフローサイトメトリー用抗体パネルで同時に染色することがよくあります。抗体パネルを使用するにあたり、各抗体に応じた固定剤等の試薬の組み合わせが1種類とは限らないため、慎重に実験を計画する必要があります。例えば、細胞の表現型を決定するCDマーカーに対する抗体は、固定されていない生細胞に使用するために開発されているため、CDマーカー抗体の中には固定・透過処理操作により十分に機能しなくなるものもあります。細胞内用抗体を使用するべく固定・透過操作を実施する際に、細胞表面マーカーを併用する場合は、事前にメーカーの推奨事項をご確認ください。情報がない場合は、予備実験を実施し固定・透過処理条件に対する抗体の適否を確認してください。適否を確認する場合は、2本のチューブに生細胞を分注し、1本は計画する固定・透過操作を実施してから細胞表面マーカーに対する抗体とインキュベーションし、もう1本は固定・透過操作を実施せず生細胞を細胞表面マーカーに対する抗体と直接インキュベーションします。続けてフローサイトメトリーを実施・解析します。固定・透過処理試料においても、陽性群と陰性群に明瞭な差が見られる場合は、細胞内マーカー用抗体と細胞表面マーカー用抗体を共にインキュベーションして実験を実施することができます。
固定・透過処理を実施すると細胞表面マーカーが機能しない場合、メタノールの代わりにサポニン等のタイプの異なる透過剤を試してみましょう。その他の代替策としては、最初に細胞表面マーカーに対する抗体と生細胞をインキュベーションし、その後に固定・透過処理を実施して細胞内用抗体で染色する連続的な染色ステップを利用することもできます。各ステップの連続的染色プロトコールにより、最良の実験結果を得られる場合が多くありますが、細胞表面マーカーに対する抗体に標識されている蛍光物質が透過剤と適合性を有するかを確認することが重要となります。APC(Allophycocyanin)やPE(Phycoerythrin)のようなタンパク質からなる蛍光物質は、メタノールによる透過処理で変性してその蛍光特性が阻害されます。
固定・透過処理プロトコール
以下のプロトコールは自分自身で固定・透過処理を実施する際のプロトコールの一例です。実際の操作は試料の種類や利用する機器により異なります。
1. 4% PFAによる固定プロトコール
1チューブあたり1×106個の細胞を含む単一細胞懸濁液を調製する。必要に応じて、固定処理の前に細胞表面抗原の染色を実施する。
1.1 1×PBSで細胞を洗浄し、遠心して細胞をペレット化する(一般的に200~300×gで2~5分間遠心すれば十分にペレット化する)。上清を捨てる。
1.2 1チューブあたり4% PFA(氷冷したもの)を~100µl添加し、穏やかにボルテックスしてペレットを再懸濁する。室温で20分間インキュベーションする。
1.3 1×PBSで細胞を洗浄し、細胞をペレット化する(1.1と同様の操作をする)。上清はPFA含有廃液用の容器に捨てる。
1.4 透過処理を実施する。または1×PBSに再懸濁し、4℃、overnightで保存する。
2. メタノールによる透過処理プロトコール
メタノールは、タンパク質からなる蛍光物質を変性することに留意する。透過処理の前にこうした蛍光物質を添加しないこと。
2.1 (必要に応じてovernight保存した後)PBSを除去し、氷冷した90%メタノール溶液を~100µl添加し、穏やかにボルテックスする。細胞試料はあらかじめ冷却しておくこと。
2.2 氷上で15分間インキュベーションする。
2.3 1×PBSで洗浄し、メタノールを除去する(1.1と同様の操作をする)。
2.4 使用する抗体の標準プロトコールに従い、免疫染色を実施する。
3. Triton X-100による透過処理プロトコール
使用する抗体bufferが0.1~0.3% Triton™ X-100含有溶液となるよう、必要量の透過bufferを調製する。抗体bufferには0.5% BSA含有1×PBS等がある。
3.1 1.1~1.3までの固定処理を実施する。
3.2 細胞透過buffer ~100µlに再懸濁する。
3.3 室温で10分間インキュベーションする。
3.4 1×PBSで洗浄し、透過bufferを除去する(1.1と同様の操作をする)。
3.5 使用する抗体の標準プロトコールに従い、免疫染色を実施する。
4. サポニンによる透過処理プロトコール
抗原の中にはメタノールやTriton X-100等の作用の強い透過剤と適合しないものがある。このような抗原の場合、作用の弱い界面活性剤であるサポニンを使用する。サポニンによる透過は可逆的であるため、透過処理後の洗浄bufferや抗体のインキュベーションbufferにもサポニンを添加すること。細胞透過/洗浄bufferを、0.1% サポニン・0.5% BSA含有1×PBSとなるよう調製する。
4.1 1.1~1.3までの固定処理を実施する。
4.2 細胞透過buffer ~100µlに再懸濁する。
4.3 室温で10分間インキュベーションする。
4.4 上記の細胞透過/洗浄bufferを使用して、免疫染色を実施する。
5. 固定処理を実施しない場合のサポニンによる透過処理プロトコール
場合によっては、PFA等の固定剤は細胞内抗原を変性させます。こうした試料の場合、光散乱法による測定を重視しない場合(例:単一の細胞株の測定)、サポニン存在下で、固定していない細胞の細胞内抗原を染色することができます。この方法は、ヨウ化プロピジウム(PI)等を使用したDNA含量の測定にも適している方法です。
5.1 1チューブあたり1×106個の細胞を含む単一細胞懸濁液を1×PBSで洗浄し、ペレット化する。
5.2 0.3%サポニン含有1×PBS 1mlを添加し、一次抗体を細胞ペレットに結合させる。
5.3 穏やかにボルテックスして4℃で30分間インキュベーションする。
5.4 遠心して上清を捨て、0.1% サポニン含有PBSで洗浄し、再度遠心する。
5.5 オプション:ヨウ化プロピジウム(PI)濃度が10µg/mlの0.3%サポニン含有1×PBS 1~2mlを添加する。4℃で10分間インキュベーションする。
5.6 直ちにフローサイトメーターで解析する。
概要
以下は、よく使用される固定・透過処理の方法とTipsをまとめた表です。
|
メタノール |
Triton-X |
サポニン |
未固定/サポニン |
|
|
使用法: |
ほとんどの細胞内ターゲットにアクセス可能。 メタノール単独で固定・透過剤として使用可能。 DNA解析に適している。 多くの場合、リン酸化マーカーに適している。 |
ほとんどの細胞内ターゲットにアクセス可能。 氷冷したPFAによる固定処理後に使用。 タンパク質からなる蛍光物質を使用する際に適している。 |
多くの細胞内ターゲットにアクセス可能。 核染色には適さない場合がある。 メタノールを使用すると目的タンパク質のエピトープが変性してしまう場合の代替剤として適している。 氷冷したPFAによる固定処理後に使用。 |
固定処理により細胞内の抗原が変性してしまう場合の代替法。 DNA含有量を測定する場合に適している。 |
|
Tips: |
タンパク質からなる蛍光物質を変性させる。 氷冷したメタノールを使用すること。 |
ある種のクローンやタンパク質を解析したい場合は、異なる透過作用の試薬が適している場合がある。 |
サポニンによる透過処理は可逆的であるため、実験操作時は透過処理後に使用するすべてのbufferにサポニンを添加する。 |
光散乱法による測定に影響を及ぼすおそれがある。 |
その他の資料について
より詳細な情報は、Krutzik, Nolanらによる様々なリン酸化タンパク質の固定および透過処理法の比較に関する、数多く引用されている論文をご参照ください(2003、Cytometry Part A、PMID: 14505311)。一般的なフローサイトメトリーに関する情報をお探しの場合は、Cossarizzaらによるレビューをご参照ください(2019、Eur J Immunology、PMID: 31633216)。


