GFP-Trap®:免疫沈降に最適なGFP抗体
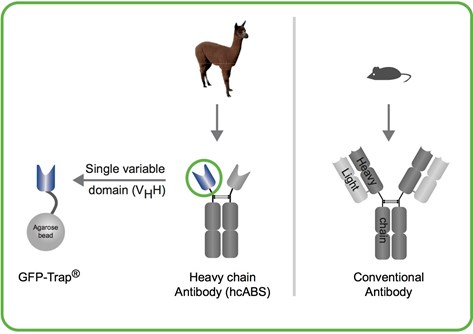
GFP-Trap®に用いられるVHH抗体(別名:Nanobody®)と従来型GFP抗体(IgG)の比較
生命科学研究では、緑色蛍光タンパク質(GFP:Green fluorescent protein)を利用し、蛍光顕微鏡観察によるタンパク質局在、タンパク質相互作用、タンパク質動態の解析が実施されます。タグ融合タンパク質に対する免疫沈降(IP:Immunoprecipitation)、質量分析(MS:Mass spectrometry)、共免疫沈降(Co-IP)、アフィニティ精製等のアプリケーションの実施は、ターゲットタンパク質や相互作用因子の翻訳後修飾(PTM:Posttranslational modification)、DNA結合、タンパク質間相互作用等のさらに詳細な解析を可能にします。本稿では、GFP融合タンパク質の免疫沈降に用いられる2種類の異なる抗体システムである「GFP-Trap®」と「従来型GFP抗体(IgG)」を比較します。
GFP-Trap®のVHH抗体(別名:Nanobody®)と従来型GFP抗体(IgG)の構造的な違いとは?
GFP-Trap®は、アルパカ由来の抗GFP VHH抗体(別名:Nanobody®、緑の円部分)が結合した免疫沈降用ビーズです。VHH抗体(別名:Nanobody®)は、アルパカ、ラマ、ラクダ、ヒトコブラクダ等のラクダ科動物の重鎖抗体(重鎖のみで構成され、軽鎖を持たない抗体)に由来し、単一ドメイン抗体とも呼ばれます。
従来型のGFP抗体(IgG)は、一般的に販売されているポリクローナル抗体やモノクローナル抗体であり、2本の重鎖と2本の軽鎖で構成されるため、分子量が大きく複雑な構造をとります。
GFP-Trap®が免疫沈降に最適な理由(各トピックに移動します)
- シングルバンド精製—免疫沈降抗体に由来する重鎖や軽鎖のコンタミネーションを生じません。
- 低バックグラウンド—GFP-Trap®は厳しい洗浄条件を適用しても安定性を示すため、バックグラウンドの低い結果を得られます。
- 短いインキュベーション時間—免疫沈降に最適な速度論的結合特性。
- 高い信頼性&再現性—解離定数KD=1 pM(10-12 M)の高い親和性を示し、ターゲットタンパク質と強固に結合するため、発現レベルが低い/内在性レベルのGFP融合タンパク質に対しても免疫沈降/プルダウン実験を適用することができます。
- 検証試験実施済み—機能や構造について、極めて詳細に特性解析されています。
- 一貫した高い品質—最適化された組換え体製造プロセスと厳格な品質管理の下に、常に高品質な製品を提供します。
- 様々なGFPバリアントおよびモデル生物に適用可能—各種GFPバリアント・生物種での検証実績および適用実績があります。
- 論文使用実績—膨大な論文使用実績とアプリケーションデータを参照可能です。
- 無料サンプルを申込可能
シングルバンド精製—免疫沈降抗体に由来する重鎖や軽鎖のコンタミネーションを生じません。
GFP-Trap®は、免疫沈降用抗体に由来するコンタミネーションのない良好な結果を提供します。SDS-PAGEを実施すると、重鎖や軽鎖のコンタミネーションが認められないことが、以下のデータによって示されています。検証実験では、GFP-Trap®と、プロテインA/Gビーズに結合させた従来型GFP抗体(IgG)を用いて免疫沈降を実施しました(左:GFP-Trap®、右:従来型GFP抗体(IgG))。
免疫沈降実験で調製したサンプルをSDS-PAGEによって分離し、クマシー染色およびウェスタンブロットを実施しました。
I:インプット画分、FT:フロースルー画分、B:ビーズ結合画分
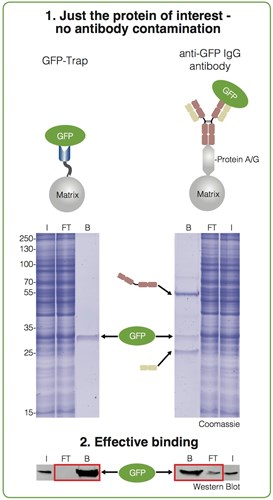
細胞抽出物中のGFPの免疫沈降実験
プルダウンされたGFPは緑で、変性した抗体重鎖は茶色で、変性した抗体軽鎖はベージュで矢印によって示されています。
GFP-Trap®のビーズ結合画分には、精製されたGFPタンパク質のバンドのみが認められます。対照的に、従来型のGFP抗体(IgG)の結合画分には、精製されたGFPタンパク質のバンドのほかに、2本の余分なバンドが認められます。25 kDaおよび50 kDa付近に認められるバンドは、免疫沈降に用いたプロテインA/Gに結合していた従来型抗体(IgG)の重鎖と軽鎖由来のコンタミネーションです。免疫沈降実験で対象とする目的タンパク質の分子量が重鎖および軽鎖の分子量に近い場合に、コンタミネーションは重大な問題となる場合があります。
低バックグラウンド—GFP-Trap®は厳しい洗浄条件を適用しても安定性を示すため、バックグラウンドの低い結果を得られます。
GFP-Trap®は、以下に示す試薬や温度条件下でも目的タンパク質と強固な結合を維持し、高い安定性を示します。そのため、厳しい洗浄条件を適用することができ、バックグラウンドを低減することができます。
• 83℃
• 1 mM DTT(ジチオスレイトール)
• 2 mM TCEP(トリス(2-カルボキシエチル)ホスフィン)
• 3 M Guanidinium HCl(グアニジン塩酸塩)
• 8 M Urea(尿素)
• 2 M NaCl
• 2% Nonidet™ P40 代替品
• 1% SDS(ドデシル硫酸ナトリウム)
• 1% Triton X-100
バックグラウンドを低減できる理由
VHH抗体の構造上の安定性に加え、免疫沈降用ビーズの結合親和性もバックグラウンドに影響します。結合親和性は、結合定数の逆数である解離定数として表されます。プロテインテックの抗GFP VHH抗体(別名:Nanobody®)の解離定数はKD=1 pM(10-12 M)と極めて低い値であり、GFPに対する高い親和性と特異性、強固な結合特性を示すため、余分な夾雑物が全て洗い流されるような厳しい洗浄条件を適用することができます。
ターゲットとの強固な結合状態が求められるアプリケーションとは?
• 高純度での精製が必要なプルダウン/免疫沈降アッセイ
• 発現レベルが低い/内在性レベルで発現するターゲットタンパク質の捕捉
• 最終的に翻訳後修飾の検出を目的する実験
• 質量分析等の再現性が求められる実験
• ユビキチン化アッセイ等の厳しい洗浄条件で実施する必要がある実験(アプリケーションノート[PDF]参照、言語:英語)
• 表面プラズモン共鳴法(SPR)におけるストレプトアビジン/ビオチン系の代替系としての利用
• クロマチン免疫沈降(ChIP)、RNA免疫沈降(RIP)等のターゲットの免疫沈降にテクニックを要する実験
抗GFP VHH抗体‐GFP融合タンパク質複合体の化学的安定性および熱安定性について解説したホワイトペーパーはこちら(PDF、言語:英語)をご覧ください。
短いインキュベーション時間—免疫沈降に最適な速度論的結合特性。
GFP-Trap®:ターゲットタンパク質と免疫沈降ビーズを結合させるためのインキュベーション工程は、細胞ライセートにGFP-Trap®を添加後、短時間で完了します。GFP-Trap®は、極めて解離定数が低いため、高感度かつ迅速にターゲットと結合し、通常、全てのワークフローは1時間以内に完了します。Co-IPを実施する場合、免疫沈降のワークフローを短縮できるため、ターゲットタンパク質との相互作用が弱いタンパク質のプルダウンが成功しやすくなる傾向があります。
従来型GFP抗体(IgG):GFP-Trap®とは対照的に、細胞ライセートに従来型GFP抗体(IgG)を結合したビーズを添加する場合、インキュベーション時間は最大12時間または一晩(overnight)で実施されます。加えて、GFP抗体‐GFP融合タンパク質複合体をプロテインA/Gビーズに結合するステップが必要となり、さらに1~2時間を要します。通常、従来型抗体を使用すると、全てのワークフローを完了させるまでに、最短で3時間あるいはそれ以上の時間を要します。
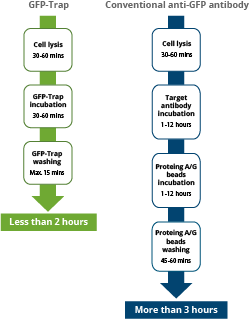
免疫沈降に要するワークフローの比較(左:アルパカ由来VHH抗体(別名:Nanobody®)を使用したGFP-Trap®、右:従来型GFP抗体(IgG))。GFP-Trap®の高い特異性と親和性により、インキュベーション時間を著しく短縮することが可能です。
高い信頼性&再現性—解離定数KD=1 pM(10-12 M)の高い親和性を示し、ターゲットタンパク質と強固に結合するため、発現レベルが低い/内在性レベルのGFP融合タンパク質に対しても免疫沈降/プルダウン実験を適用することができます。
アフィニティ担体の解離定数および結合速度定数および解離速度定数(kon/koff)といった生物物理学的特性に関する情報は、実験計画を立案する際に役立ちます。
GFP-Trap®は、徹底的に特性解析が実施され、反応速度論に関する詳細データが公開されています。
|
解離定数 |
結合速度定数 |
解離速度定数 |
|
1 x 10-12 |
2.67 x 107 |
3. 03 x 10-5 |
内在性レベルで発現する多くのタンパク質は、細胞中に1~100 nM程度の濃度で存在します。目的のGFP融合タンパク質をCRISPR/Cas等によるノックイン法によってゲノムに挿入し、発現させるような場合、その発現レベルが非常に低いことやナノモラーレベルでの発現となることがあります。その際、GFP-Trap®は目的タンパク質を免疫沈降するための最も効果的なツールとなります。
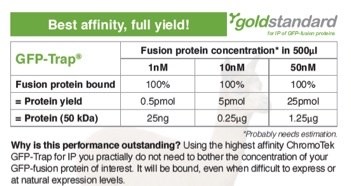
免疫沈降で捕捉される目的タンパク質の量は、目的タンパク質濃度および使用する免疫沈降ビーズの解離定数に依存します。GFP-Trap®は、KD=1 pMの解離定数を有し、非常に高い親和性を示す製品です。表に記載した数値は、所定のタンパク質量(nM)になるよう調製した総容量500 μl(サンプル溶液、バッファー、ビーズスラリーの合計)の溶液を免疫沈降に使用すると仮定して計算されました。分子量50 kDaのタンパク質5 pmolの計算上の質量は、0.25 μgに相当します。したがって、500 μlのサンプル溶液中のタンパク質濃度は10 nMとなります。タンパク質収量はGFP-Trap®の解離定数とタンパク質量に基づいて計算されました。
従来型のGFP抗体(IgG)の解離定数は、VHH抗体(別名:Nanobody®)と比べると、10~104倍程度の高い値を示す傾向にあります。親和性の低い抗体を用いた免疫沈降ツールは、発現量の少ないタンパク質の免疫沈降には適していません。
検証試験実施済み—機能や構造について、極めて詳細に特性解析されています。
GFP-Trap®は、アガロースビーズ等の免疫沈降用ビーズに結合した抗GFP VHH抗体(別名:Nanobody®)からなる製品です。抗GFP VHH抗体は、組換え技術を用いて細菌(バクテリア)で発現させた、分子量の小さい、可溶性かつ安定的な単一ポリペプチド鎖です。そのため、実質的にロット間変動は認められません。VHH抗体は、厳格な品質管理手順に基づいて生産されるため、堅牢かつ再現性の高い製品製造を実現し、信頼性のある結果を提供します。
GFP-Trap®の結晶構造は既に明らかになっており、その機能を試験した様々なアプリケーションノートが公開されています。GFP-Trap®のプロトコールおよびアプリケーションノート等の情報は製品ページから入手可能です。
• 免疫沈降(IP:Immunoprecipitation)、共免疫沈降(Co-IP)
• アフィニティ精製
• 質量分析(MS:Mass spectrometry)
• 酵素活性測定(Enzyme activity measurement)
• RIP(RIP:RNA Immunoprecipitation)解析
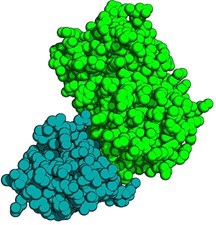
抗GFP VHH抗体(別名:Nanobody®)と緑色蛍光タンパク質(GFP)複合体の結晶構造
青緑:抗GFP VHH抗体(別名:Nanobody®)、緑:GFPタンパク質。
様々なGFPバリアントおよびモデル生物に適用可能—各種GFPバリアント・生物種での検証実績および適用実績があります。
特異性
プロテインテックは、蛍光タンパク質バリアント(変異体・改変体)や蛍光タンパク質誘導体に対する、GFP-Trap®の特異性を検証しています。
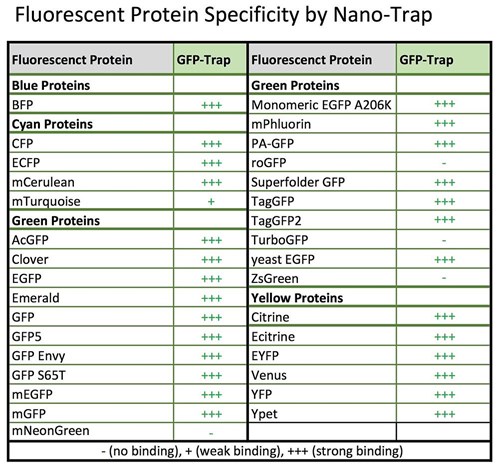
GFP-Trap®の様々な蛍光タンパク質に対する特異性
最新情報やGFP-Trap®以外のNano-Trap製品の特異性については「Fluorescent Protein Specificity by Nano-Trap[PDF]」をご覧ください。
GFP-Trap®の様々なモデル生物での使用実績
現在までに、GFP-Trap®は、様々な細胞や生物種で発現させたGFP融合タンパク質の解析に利用されています。以下に示す生物種は、GFP-Trap®の使用実績が報告されているものです。
|
真菌(Aspergillus fumigatus) |
ニワトリ(Gallus gallus domesticus) |
マラリア原虫(Plasmodium berghei) |
|
シロイヌナズナ(Arabidopsis thaliana) |
モルモットサイトメガロウイルス(GPCMV:Guinea pig cytomegalovirus) |
ペチュニア(Petunia inflata) |
|
糸状真菌(Ashbya gossypii) |
ヒト細胞株 |
繁殖型マラリア原虫(Plasmodium trophozoite) |
|
線虫(Caenorhabditis elegans) |
リーシュマニア属原虫(Leishmania sp.) |
ラット(Rattus norvegicus) |
|
ゼブラフィッシュ(Danio rerio) |
イネいもち病菌(Magnaporthe oryzae) |
イネプロトプラスト(Rice protoplast) |
|
タマホコリカビ(Dictyostelium discoideum) |
哺乳類細胞株 |
糸状菌(Sordaria macrospora) |
|
キイロショウジョウバエ(Drosophila melanogaster) |
マウス(Mus musculus) |
酵母(Saccharomyces cerevisiae) |
|
大腸菌(E. coli) |
タバコ(Nicotiana benthamiana) |
テトラヒメナ(Tetrahymena thermophila) |
|
イネ馬鹿苗病菌(Fusarium fujikuroi) |
イネ(Oryza sativa) |
トキソプラズマ原虫(Toxoplasma gondii) |
その他の生物種、詳細情報については、GFP-Trap®の論文使用実績(Publications)をご覧ください。
一貫した高い品質—最適化された組換え体製造プロセスと厳格な品質管理の下に、常に高品質な製品を提供します。
前述のとおり、GFP-Trap®の抗GFP VHH抗体(別名:Nanobody®)は細菌(バクテリア)を用いて組換え技術により産生されます。各製造ロットは厳密に品質管理され、完全に規格を満たした製品のみが出荷され、顧客の皆様の手元に届きます。別途、各ロットの保存用サンプルを保管し、製造プロセスにおける潜在的なエラーを特定するために、品質エラーを有する可能性のある製造品と保管サンプルとの比較試験が行われます。製造部門では、2015年初頭に品質管理/品質マネジメント専門のラボを開設し、専任の職員を確保しています。
論文使用実績—膨大な論文使用実績とアプリケーションデータを参照可能です。
プロテインテックのGFP-Trap®は、現在3,500報以上の査読済み論文で使用されています。GFP-Trap®は、免疫沈降ツールの中でも特に論文使用実績の多いGFPモノクローナル抗体を用いた製品であり、GFP融合タンパク質を免疫沈降するための「ゴールドスタンダード」となっています。
GFP-Trap®の論文使用実績はプロテインテックの製品ページからご覧いただけます。その他に、citeab.comのウェブサイトではCiteAbが独自に収集した論文使用実績等の情報が公開されています。
顧客の皆様の貴重なフィードバックのおかげで、プロテインテックは「GFP-Trap®」製品の開発に成功しました。GFP-Trap®に関するアイデアやご提案を提供いただいた60を超える国々の皆様にこの場を借りて御礼申し上げます。
プロテインテックでは、GFP-Trap®のサンプルを無償で提供しています。下記フォームよりご依頼ください。
(※ 国内におけるプロテインテック製品の出荷および販売は、コスモ・バイオ株式会社を通じて行っております。
最寄りのコスモ・バイオ株式会社 代理店をご指定の上、ご依頼ください。)
GFP-Trap®に関するその他の参考情報
- ChromoTek VHH(Nanobody®)試薬(Proteintech HP)
- How to plan an immunoprecipitation of your GFP-fusion protein with the ChromoTek GFP-Trap[PDF]
- Affinity tools for the immunoprecipitation of GFP-fusion proteins[PDF]
- Fluorescent Protein Specificity by Nano-Trap[PDF]
- Troubleshooting guide immunoprecipitation and CO-IP[PDF]
- Publications(GFP-Trap® Agarose)
- How to elute boud GFP-fusion protein from GFP-Trap[PDF]
- Unique Thermal & Chemical Stability of the ChromoTek GFP-Binding Protein:GFP Complex[PDF]
- On-bead digest protocol for mass spectrometry[PDF]
- Ubiquitination of GFP-tagged proteins[PDF]
- GFP-Trap® capture surface for Biacore assays[PDF]
- Enzymatic activity assay[PDF]
- Bead-based protein arrays using protein tag-specific nanobodies[PDF]
- Immunoprecipitation Sample Preparation Kit[PDF]


