タンパク質の複雑性
どのようにしてタンパク質はわずか20種類の標準アミノ酸を基に多様な機能を得るのか?
体内には20,000以上の様々なタンパク質があります(1)。タンパク質は、わずか20種類の標準アミノ酸を基にして、なぜこれほどまでに多様な機能を持つことができるのでしょうか?その答えは、一次構造、二次構造、三次構造、四次構造の複雑性にあります(図1)。
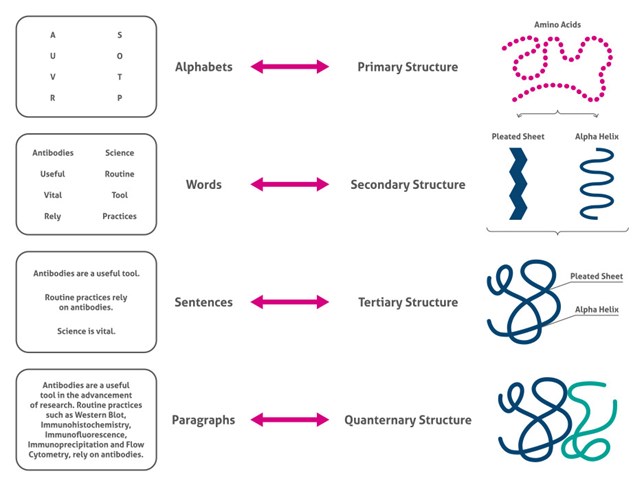
図1. タンパク質構造の4つのレベル
一次構造
一次構造は、タンパク質のアミノ酸配列からなります。この段階でも、アミノ酸の種類による酸性度、大きさ、疎水性、電荷等の重要な生化学的複雑性が絡みあっています。酸性度だけを挙げても、中性(例:アラニン)、酸性(例:アスパラギン酸)、塩基性(例:アルギニン)の3種類のアミノ酸があります。
二次構造
二次構造は、ペプチド結合の相互作用による小規模な三次元構造からなります。主要な構造には、αヘリックスとβシートがあります。αヘリックスは右巻きのコイル状構造をとります。側鎖はコイルの外側に向かい、あるアミノ酸のN-H基とそこから4つめのアミノ酸のC=O基間の水素結合によって構造が保持されています。例えば、ミオグロビンは複数のαヘリックスを持つタンパク質です。βシートは、隣接するペプチド鎖のアミノ酸のN-H基とC=O基の相互作用によってプリーツ状構造をとります。絹の主成分であるフィブロインは、ほぼ全体がβシートです(2)。
三次構造
三次構造は、側鎖、αヘリックス、βシート間の様々な相互作用によって生じるタンパク質ドメインの三次元コンフォメーションです。計算化学的手法は絶えず進歩していますが(3)、X線結晶構造解析は、依然としてタンパク質の構造を知るための最も信頼できる方法です(4)。
四次構造
四次構造は、複数のサブユニットからなるタンパク質のサブユニットの配置をさします。四次構造を持つタンパク質の例として、抗体やヘモグロビンが挙げられます。これらの4つの構造に加えて、タンパク質は、翻訳後修飾によって機能が更に変化します。詳細については、プロテインテックのブログ記事「翻訳語修飾」をご覧ください。

