特集 : 神経幹細胞/神経前駆細胞(NSC/NPC)マーカー
特定のサブタイプのニューロンとグリア細胞の同定ツールとしてのNSC/NPCマーカー
人工多能性幹細胞(iPS細胞、iPSC:induced pluripotent stem cell)は、胚性幹細胞(ES細胞、ESC:embryonic stem cell)と同様に、領域特異的な神経前駆細胞(NPC:Neural progenitor cell)に誘導し、最終的に特定のニューロンサブタイプとグリア細胞に分化させることができます(1,2)。
神経前駆細胞(NPC)は、自己複製能と分化多能性を持つ細胞、つまり増殖して神経前駆細胞群(NPCプール)を維持するとともに、領域的・空間的に異なるニューロンとグリア細胞に分化して特定の機能を果たすことが可能な細胞の集団です。化学的に組成の明確な神経誘導培地で神経幹細胞(NSC:Neural stem cell)を培養すると、前駆細胞から様々なサブタイプのニューロンに分化します。
増殖性神経前駆細胞(NPC)は、SOX2(SRY (sex determining region Y)-box 2)とPAX6(paired box 6 )(図1)を発現していることが特徴です。
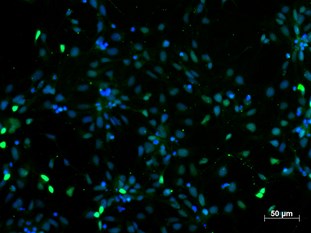
図1. 4% PFA固定ヒト人工多能性幹細胞(hiPSC)由来の神経前駆細胞(NPC)を用いたPAX6(品番:12323-1-AP、1:250希釈)の免疫蛍光染色(緑:PAX6、青:DAPI)。BioTalentum社(ハンガリー)の提供。
胚性幹細胞(ES細胞)由来の神経前駆細胞(NPC)は、3種類の主要な神経系細胞(ニューロン、アストロサイト、オリゴデンドロサイト)に分化させることができます。妊娠4週目から6週目まで、ヒト神経前駆細胞(NPC)は、数回の対称分裂で以後の神経分化のために決まった数の細胞を準備します。ヒト皮質ニューロンの分化は、妊娠6週目に開始されます。この時点で、神経前駆細胞(NPC)の対称分裂は非対称分裂に変わります。神経前駆細胞(NPC)の非対称分裂により、1つの神経前駆細胞(NPC)と、1つのニューロンまたはグリア細胞が生じます(3)。
通常、in vitroでの神経誘導の効率は、NESTIN、PAX6、およびSOXの遺伝子発現分析によって監視されます(4)。皮質ニューロンへの最終分化については、TUBB3(Tubulin Beta 3 class III)(図2)とMAP2(microtubule-associated protein 2)(図3)の発現レベルの分析によって細胞を監視します。
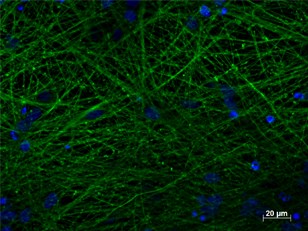
図2. 4% PFA固定hiPSC由来神経培養(35日培養)を用いたTUBB3(品番:66375-1-lg、1:250)の免疫蛍光染色(緑:TUBB3、青:DAPI)。BioTalentum社(ハンガリー)の提供。
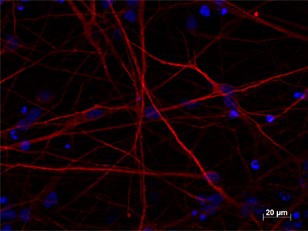
図3. 4% PFA固定hiPSC由来神経培養(35日培養)を用いたMAP2(品番:17490-1-AP、1:250希釈)の免疫蛍光染色(赤色:MAP2、青色:DAPI)。BioTalentum社(ハンガリー)の提供。
神経前駆細胞(NPC)由来のニューロン集団は、ニューロンマーカー(MAP2およびTUBB3)に対する抗体を使用して決定し、単層培養系または3D構造物によってニューロン分化をさらに進めることができます(図4)。神経前駆細胞(NPC)は、in vitroでの細胞モデリングと神経発生の模倣、神経変性疾患の動的病理の解明、および細胞補充療法の実現のための新しいツールとなります(5, 6)。
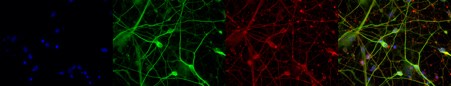
図4. 4% PFA固定hiPSC由来神経培養(35日培養)を用いたMAP2(品番:17490-1-AP、1:250希釈)とTUBB3(品番:66375-1-lg、1:250)の免疫蛍光染色(赤色:MAP2、緑色:TUBB3、青色:DAPI)。BioTalentum社(ハンガリー)の提供。
参考文献
2) Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling.
3) Asymmetric cell division during neurogenesis in Drosophila and vertebrates.

