細胞運命の拘束とワディントンのランドスケープモデル
ワディントンのエピジェネティック・ランドスケープは、発生時の細胞分化の漸進的な制約を説明するために何十年にもわたって利用されてきました。
ワディントンのランドスケープモデルと現代の課題
1957年、Conrad Waddington(コンラッド・ワディントン)は、哺乳類の発生は、一方向性であると述べました。それは、胚性幹細胞(ESC:embryonic stem cell)がより成熟した分化状態の細胞になるということを意味します。
この概念は「ワディントンの山」の頂上から谷底へ転がり落ちるボールの形で表現されてきました(図1A)。この図は、正常発生時に細胞が分化する能力が生来受ける制約を視覚的に示しています。しかし、一連の画期的な実験により、細胞の運命は、柔軟で可逆的であることが示されました。人工多能性幹細胞(iPSC:induced pluripotent stem cell)は、様々な種類の体細胞のリプログラミングによって作製可能であり、得られたiPSCを別の種類の体細胞に分化させることができるという画期的な発見から、多能性状態はワディントンモデルの山頂で異なる分化系列とつながる中心にいるような状態にあるといえます(図1B)。さらに、細胞の運命が相互転換性を有するか否かという考え方については、多能性という概念とは関係ない場面で、数十年前にすでに議論されていました。その後のさらなる研究で、同一の胚葉層内にある関連する系統間の細胞運命の転換が成功したことを示す追加のエビデンスが提示されました(図1C)。
しかし、ある胚葉の細胞が別の胚葉に属する種類の細胞に転換できるかどうかは不明であったため、この考え方を普遍的な概念にするには、まだ多くの研究が必要です。
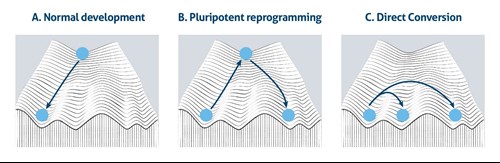
図1. ワディントンのエピジェネティック・ランドスケープモデル、A)正常発生時(Normal Development)、B)多能性リプログラミング時(Pluripotent Reprogramming)、c)直接転換時(Direct Conversion)。
リプログラミングの際、実際に細胞は分化した状態から多能性の状態に移行することが今では明らかになっています。実験で得られた細胞の可塑性に関する最初の徴候は、除核卵への体細胞核の移植実験や体細胞と多能性細胞の融合実験等によるものでした。これらの実験により、体細胞ゲノムのエピジェネティックプログラムは消去することが可能で、細胞を多能性状態にまで若返らせることができると実証されました。
また、組織特異的転写因子の異所性発現は、分化転換(細胞の直接転換)として知られているプロセスで、分化した細胞を別の系統の細胞に変換できることを示唆しています。このプロセスは、概念的に、ワディントンのランドスケープの尾根を横切って、1つの谷から別の谷へと移動する形で表現されます(図2)。
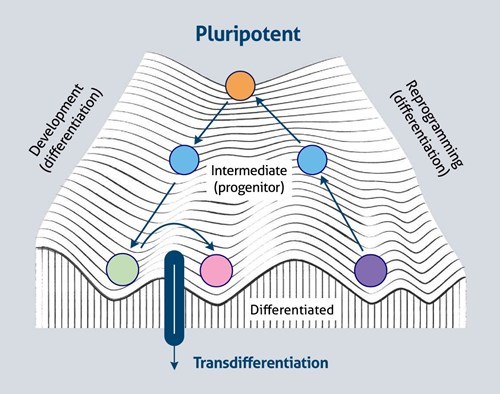
図2. 細胞運命の可塑性とワディントンのランドスケープ(参考文献(2)の図に基づく)。
ヒト多能性幹細胞の概念
2006年、山中教授らは、疾患のモデリングと再生医療のための新しいパラダイムを構築しました(3)。彼らのコンセプトは、選択された4つの転写因子Oct3/4、Sox2(図3)、Klf4(図4)、c-Mycを組み合わせて、この4遺伝子のレトロウイルス導入により、マウス胚性培養物または成体線維芽細胞培養物から直接iPSCを作製するというものでした。この概念は後に、ヒトの体細胞で実践されました(4)。
 |
 |
| 図3. SOX2抗体(カタログ番号:20118-1-AP、希釈倍率1:50)、Alexa Fluor 488標識AffiniPureヤギ抗ウサギIgG(H+L)抗体を使用した、マウス胚組織(4%PFA固定)の免疫蛍光染色解析像。 | 図4. KLF4抗体(カタログ番号:11880-1-AP、希釈倍率1:200)を使用した、パラフィン包埋マウス胚組織スライドの免疫組織化学染色(10倍レンズを使用)。Tris-EDTA buffer(pH9)で熱処理し抗原賦活化した試料を使用。 |
ワディントンのモデルでは、幹細胞が山の頂上にあり、小さなボールのように転がり落ちていくことで、より分化した細胞になると仮定されていました(5)。当時、細胞は不要な遺伝子の消去、または不活性化によって特定の細胞に分化すると考えられていました。その後、1962年に、ガードンは核のリプログラミングによって、成体の体細胞を多能性幹細胞(PSC:pluripotent stem cell)に復元できることを初めて示しました。彼は、オタマジャクシの体細胞の核を除核卵母細胞に移植して、卵母細胞の細胞質中の因子が体細胞核を多能性状態にリプログラムできることを示し、クローン化したカエルの作製に成功しました(6)。これは、細胞が自らの分化中にその情報を失うわけではなく、使用されていない遺伝子はただ沈黙しているだけで、適切な刺激に曝されると再活性化できることを意味しています。
ヒト胚性幹細胞(ESC:embryonic stem cell)とiPSC
ヒトESCとiPSCは自己複製能力があり、in vitroでは3つの胚葉層すべてに分化することができます。着床前胚の内部細胞塊から単離されたヒトESCは、実験目的での導出に倫理的な課題があります(7)。したがって、ヒトESCの研究利用には一定の制限を伴います。近年、iPSCを作製する画期的な技術が幹細胞研究や幹細胞治療の新たな道を切り開きました。マウス由来のiPSCは、2006年に多能性転写因子の過剰発現を介して体細胞をリプログラミングすることにより得られました(3)。これらのiPSCは、自己複製能と3種類の胚葉層すべてへの分化能を有するという点においてESCに類似しています。2007年、最初に発表された山中因子(Oct3/4、Sox2、Klf4、c-Myc)(4)、または類似のヒト多能性遺伝子(OCT4(図5)、SOX2、NANOG、LIN28(図6))のいずれかを異所的に共発現させることにより、ヒトiPSCをヒト体細胞からリプログラミングさせることに成功しました(8)。

図5. OCT3/4抗体(カタログ番号:11263-1-AP、希釈倍率1:50)を使用した、ヒト胚性幹細胞の共焦点免疫蛍光染色解析像(FITC:OCT3/4抗体とFITCによる染色像)。
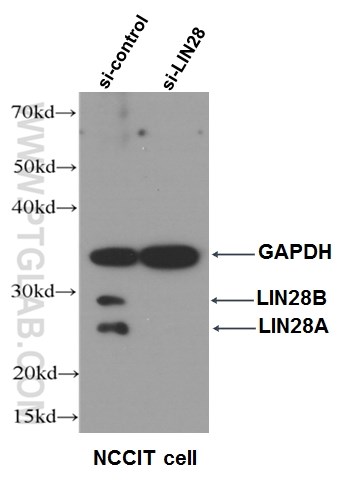
図6. LIN28抗体(カタログ番号:11724-1-AP、希釈倍率1:500)を使用したNCCIT細胞のWB(ウェスタンブロット)データ。右:si-LIN28トランスフェクション細胞、左:siコントロール細胞。
ヒトiPSCは、形態学的および機能的特性等、ヒトESCの特性を示します(9)。したがって、ヒト体細胞由来のヒトiPSCは、臓器発生の再現、ヒト疾患のモデル化、新薬の標的のスクリーニング、in vitroおよびin vivoでの患者個人に特化した再生医療の開発を行うための有望なツールです。
参考文献
5. C H WADDINGTON. Genetic assimilation. Adv Genet. 1961;10:257-93.
6. J B GURDON. Adult frogs derived from the nuclei of single somatic cells. Dev Biol
. 1962 Apr;4:256-73.


