COVID-19の様々な臓器への影響
Alicia Haydo著(ゲーテ大学フランクフルト・アム・マイン、PhD candidate)
新型コロナウイルス感染症(COVID-19)は、新型コロナウイルス(SARS-CoV-2)の感染によって引き起こされる急性呼吸器症候群です。新型コロナウイルスは2019年に中国武漢で確認された後、2020年に入ってから各国に広がり世界的大流行を引き起こしました。3年以上が経過した現在も世界中で感染者が発生しています。これまでの研究によって肺を含む呼吸器症状に関するCOVID-19の文献が多数公表されています。しかし、COVID-19は呼吸器だけに影響を与えるわけではありません(Jain, 2020)。COVID-19は急性期と罹患後の両方で、人体の臓器に対して多くの有害な作用を示す可能性があり、罹患後症状を含めたその長期的な影響についてはいまだに解明されていません。
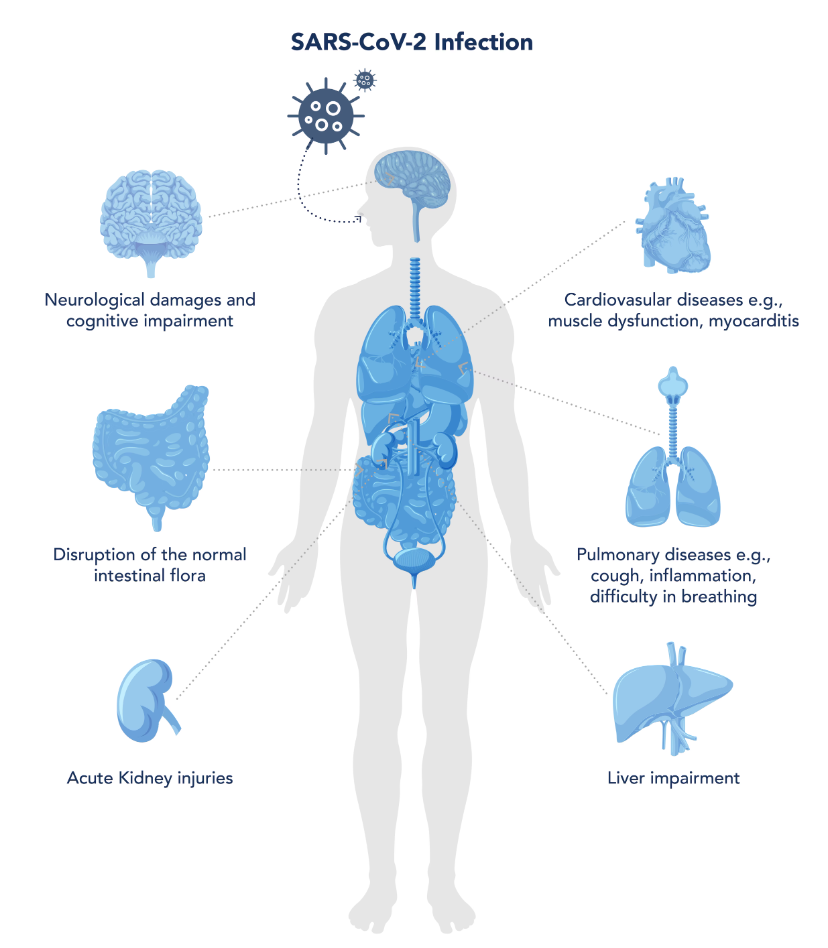
図1. 様々な臓器へのCOVID-19の影響(Proteintech Groupの資料より)
1. 心臓に対するCOVID-19の影響
心血管系疾患は、SARS-CoV-2感染に伴い高頻度に認められる合併症の1つです。しかし、感染後の心筋損傷の具体的な機構は明らかになっていません。ウイルスは、a)心筋組織に直接的に侵入し、心血管系に広く分布するACE2受容体(アンジオテンシン変換酵素II、コロナウイルス受容体)を介した障害を引き起こす、あるいはb)全身性障害の原因となる制御不能なサイトカインストームを引き起こすという2通りの方法で心臓を損傷させる可能性が考えられます。重症化率の高さは感染者個人の心血管疾患の潜在的リスクと相関性があることが想定され、このリスクがCOVID-19罹患後に心臓に影響を及ぼす可能性を高めています(Shah et al. 2021)。SARS-CoV-2は血管内皮細胞に直接感染することでアポトーシスを引き起こし、血液中の血小板や白血球との相互作用を変化させる可能性があることが報告されています。さらに、血管内皮細胞が産生する一酸化窒素やプロスタグランジン等の血管収縮に作用する物質のバランスを崩壊させたり、活性酸素種(ROS:Reactive oxidative species)を増加させることで、様々な臓器で多くのCOVID-19関連症状に関与すると考えられる「免疫血栓(Immunothrombosis)」を生じさせる可能性があります(Roy et al. 2022)。SARS-CoV-2感染による有害な影響は、心不全、心筋炎、細胞壊死、不整脈等の心筋機能障害として現れる可能性があります(Shah et al. 2021)。
2. 肝臓に対するCOVID-19の影響
SARS-CoV-2感染後の肺以外の合併症には、心血管系疾患に加えて肝障害も挙げられます。アラニンアミノトランスフェラーゼ(ALT)やアスパラギン酸アミノトランスフェラーゼ(AST)等の肝機能検査の値は、COVID-19罹患者では様々な程度の異常値を示します。ACE2受容体は肝細胞や肝臓の胆管細胞にも発現していることから、SARS-CoV-2の直接的感染が肝機能障害を引き起こすという仮説があります(Shah et al. 2021)。COVID-19に罹患し入院した患者の75%以上が肝機能検査で異常値を示し、約20%の患者には肝臓損傷も認められたことが報告されています(Cai et al. 2020)。また、COVID-19は炎症誘発性サイトカインのプロファイルの変化と関連付けられており、この炎症誘発性サイトカインは感染初期や感染後期の肝機能異常に実質的に関与していると考えられます(Dufour et al. 2022)。
3. 消化器系に対するCOVID-19の影響
これまで示された多くのエビデンスはSARS-CoV-2が罹患者の消化器系に影響を及ぼすことを示唆しており、下痢、食欲不振、吐き気、嘔吐、腹痛等の様々な症状につながっていると考えられています。COVID-19の消化器系への影響は、感染者が必要とする栄養分を摂取するうえで大きな課題となります。栄養素が腸粘膜と接触できなくなり、さらに免疫系機能が低下することで、細菌のバクテリアルトランスロケーション(Bacterial translocation、腸内細菌が腸管上皮を通過して腸管外の臓器に移行する現象)の亢進につながる可能性があります。消化器系に対するSARS-CoV-2の影響は回腸や結腸にACE2受容体が豊富に存在することが一因であると提唱されています。ヒト小腸ではACE2受容体は小腸近位部および遠位部の腸管上皮細胞で高く発現していることが示されています。腸管上皮細胞は特に外来病原体や食物粒子に直接的に暴露されるため、ウイルスが消化器系のACE2受容体に接触して正常な腸内細菌叢に影響を与えることで、様々な消化器系症状が引き起こしている可能性が示唆されます(Shah et al. 2021)。さらにMeringerらは、COVID-19に罹患した患者のサブセットにおいて、数か月経過後も慢性的かつ異常な炎症や自己免疫が誘導されるエビデンスを示しています(Meringer et al. 2022)。
4. 脳に対するCOVID-19の影響
嗅覚障害や、筋肉痛、頭痛、脳障害、めまい、味覚障害は、SARS-CoV-2感染の軽症例に認められる典型的な神経症状です。重症の場合は、けいれん、運動障害、感覚障害、運動失調、脳卒中等の合併症を伴うことがあり、このような症状は感染してから完全に回復した後であっても発生・持続する可能性があります。SARS-CoV-2は、血流にのって脳に到達し、ACE2受容体を介して内皮細胞に接触し、その後血液脳関門(BBB)を改変してウイルスを中枢神経系に拡散する説が考えられています。さらに、IL-1β、IL-17、IL-6、TNF-α等のサイトカインは血液脳関門の透過性を変化させ、ウイルスの侵入に寄与している可能性があります(Shah et al. 2021)。特に、SARS-CoV-2の神経侵襲において、嗅部は重要な役割を担います。嗅覚と味覚の喪失は報告例の多い感染症状であり、ウイルスが嗅神経細胞を乗っ取り細胞死を含む何らかの障害を与えている可能性が検討されています(Esposito et al. 2022)。ウイルスが感染した嗅神経細胞はウイルスが気道から脳に侵攻するためのキャリアとして働く可能性があります(Shah et al. 2021)。
5. 腎臓に対するCOVID-19の影響
急性腎障害(AKI)はCOVID-19感染で発症する可能性のあるもう1つの合併症であり、重症化率の上昇との関連性が示唆されています。腎障害の作用機序として、腎臓や膀胱にはACE2遺伝子が発現しているため、呼吸器、肝臓、消化器系に加え、泌尿器系がウイルスのもう1つの侵入経路となり、それによる直接的感染が原因となる可能性が考えられています(Shah et al. 2021)。SARS-CoV-2ウイルスは、急性尿細管壊死を引き起こす場合があります。また、腎臓へのウイルスの向性(親和性)が示唆される研究結果や、虚脱性巣状分節性糸球体硬化症が観察される症例も存在します(Liakopoulos et al. 2022)。COVID-19を治療するために処方された薬が間接的に腎臓に影響を及ぼす可能性もあります(Silva et al. 2021)。
今後の研究展開について
研究者はCOVID-19の急性期の治療法の開発の他に、Long COVID-19(COVID-19罹患後症状)の症例にも関心を寄せています。Cauらは興味深い試みとして、AIを使用したモデルを詳述しています(Cau et al. 2022)。論文では、臨床医の診断をサポートし、患者のケアやリハビリテーション病棟への極めて大きな負担を軽減するために、Long COVID-19患者に画像診断AIモデルを適用できると紹介しています。とりわけ、Long COVID-19は広範囲に及ぶ全身性の機能障害を引き起こすため、この多因子性障害に対して様々な治療法を検討する必要があります。ウイルス感染による広範な炎症状態に対処するために、抗炎症治療はLong COVIDの治療法を研究するうえで極めて重要な領域です。一般的な選択肢としては、インフリキシマブ(TNFα阻害薬)、トシリズマブ(IL-6受容体阻害薬)、シルツキシマブ(IL-6阻害薬)、アナキンラ(IL-1受容体拮抗薬)、レロンリマブ(CCR5阻害薬)等の抗体製剤・生物学的製剤による治療が挙げられます。2021年から2023年にかけては、Long COVIDに対するセロトニン再取り込み阻害・セロトニン受容体調節剤である抗うつ剤ボルチオキセチンの有効性を検証する臨床試験が実施されています(Koc et al. 2022)。また、オルガノイドモデルを使用してウイルスの作用機構を解明しようと試みる研究者も存在します。Kimらによる論文は、オルガノイドによって様々な臓器におけるウイルスの細胞向性を明らかにし、COVID-19治療の候補薬を同定したと述べています(Kim et al. 2022)。
最後に
臓器におけるSARS-CoV-2の侵入経路や拡散経路に関する新たなエビデンスは、肺、心臓、肝臓、消化器系、脳、腎臓内で、ウイルスが効率的に複製されていることを示唆しています。さらなる仮説を検証するためのオルガノイドやその他の実験手法の開発により、SARS-CoV-2ウイルスを解明し治療することができる研究への道が拓かれるでしょう。
プロテインテックのSARS-CoV-2検出用ELISAキット
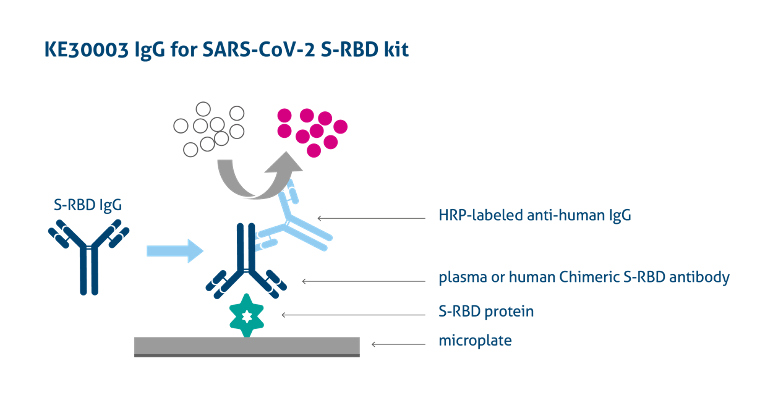
画像引用元:https://www.ptglab.com/products/Virus-IgG-for-2019-nCoV-S-RBD-ELISA-Kit-KE30003.htm
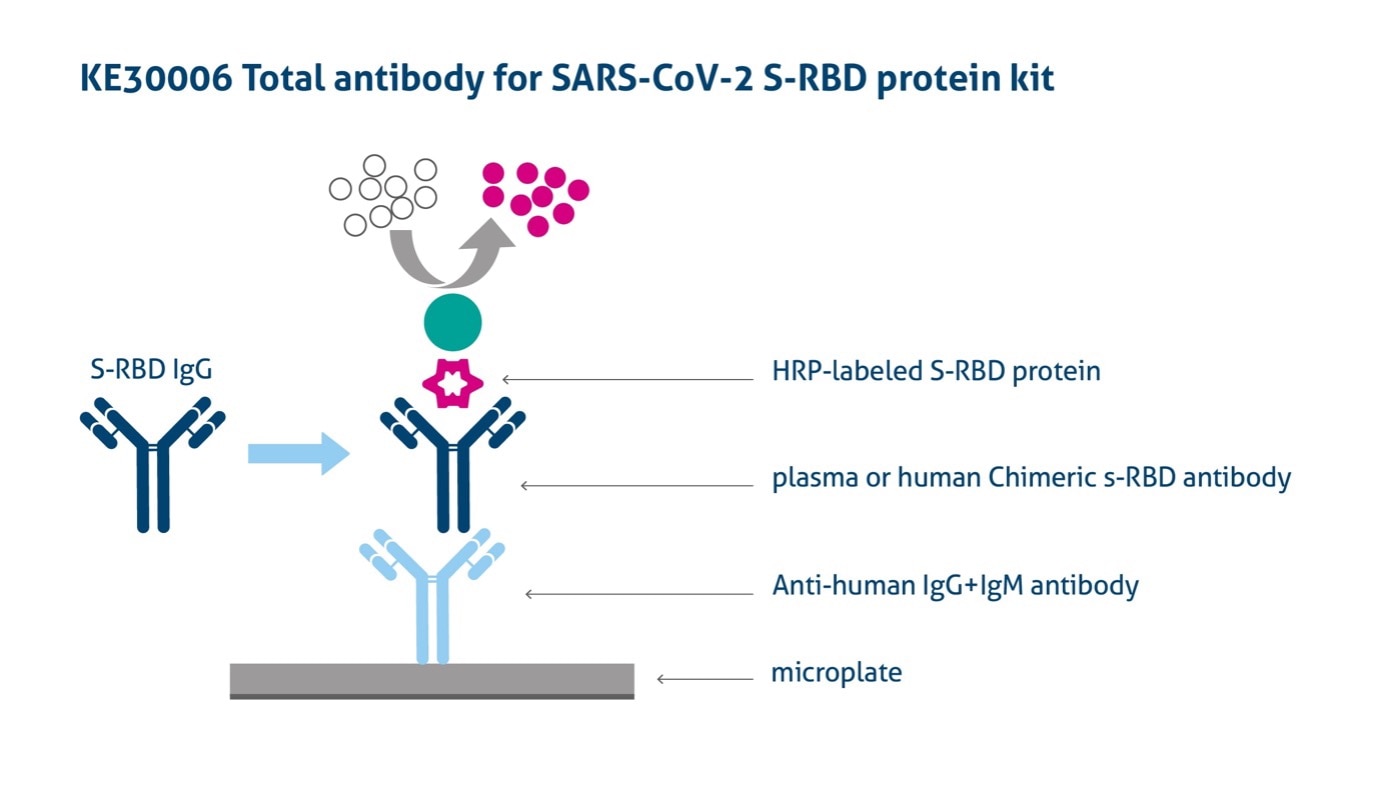
画像引用元:https://www.ptglab.com/products/Virus-SARS-CoV-2-S-RBD-ELISA-Kit-KE30006.htm
新型コロナウイルスの研究、製品、その他関連情報についてはコロナウイルス (COVID-19) 関連製品ページをご覧ください。
プロテインテックは抗SARS-CoV-2抗体およびSARS-CoV-2抗原を検出するための間接ELISA法、キャプチャーELISA法、サンドイッチELISA法を用いたキットを販売しています。詳細はSARS-CoV-2(COVID-19)研究用ELISAキットページをご覧ください。
参考文献
- U Jain. Effect of COVID-19 on the Organs. Cureus. 2020 Aug 3;12(8):e9540.
- MD Shah, BAV Maran, KF Rodrigues, et al. A mini-review on the impact of COVID 19 on vital organs. Biomed Pharmacother. 2021 Nov:143:112158.
- R Roy, B McDonaugh, K O'Gallagher. COVID-19 and the heart. Br Med Bull. 2022 Dec 12;144(1):4-11.
- Q Cai, D Huang, H Yu, L Liu, L Xu, et al. COVID-19: Abnormal liver function tests. J Hepatol. 2020 Sep;73(3):566-574.
- J-F Dufour, et al. COVID-19 and liver disease. Gut. 2022 Nov;71(11):2350-2362.
- H Meringer, S Mehandru. Gastrointestinal post-acute COVID-19 syndrome. Nat Rev Gastroenterol Hepatol. 2022 Jun;19(6):345-346.
- F Esposito, et al. Olfactory loss and brain connectivity after COVID-19. Hum Brain Mapp. 2022 Apr 1;43(5):1548-1560.
- V Liakopoulos, et al. COVID-19 and the kidney: time to take a closer look. Int Urol Nephrol. 2022 May;54(5):1053-1057.
- NAO Silva, et al. Potential kidney damage associated with the use of remdesivir for COVID-19: analysis of a pharmacovigilance database. Cad Saude Publica. 2021 Nov 12;37(10):e00077721.
- R Cau, et al. Long-COVID diagnosis: From diagnostic to advanced AI-driven models. Eur J Radiol. 2022 Mar:148:110164.
- HC Koc, et al. Long COVID and its Management. Int J Biol Sci. 2022 Jul 11;18(12):4768-4780.
- J Kim, et al. Organoid Studies in COVID-19 Research. Int J Stem Cells. 2022 Feb 28;15(1):3-13.


