ヒト疾患におけるフェロトーシスの役割
Dharaniya Sakthivel著(ベイラー医科大学博士課程在籍)
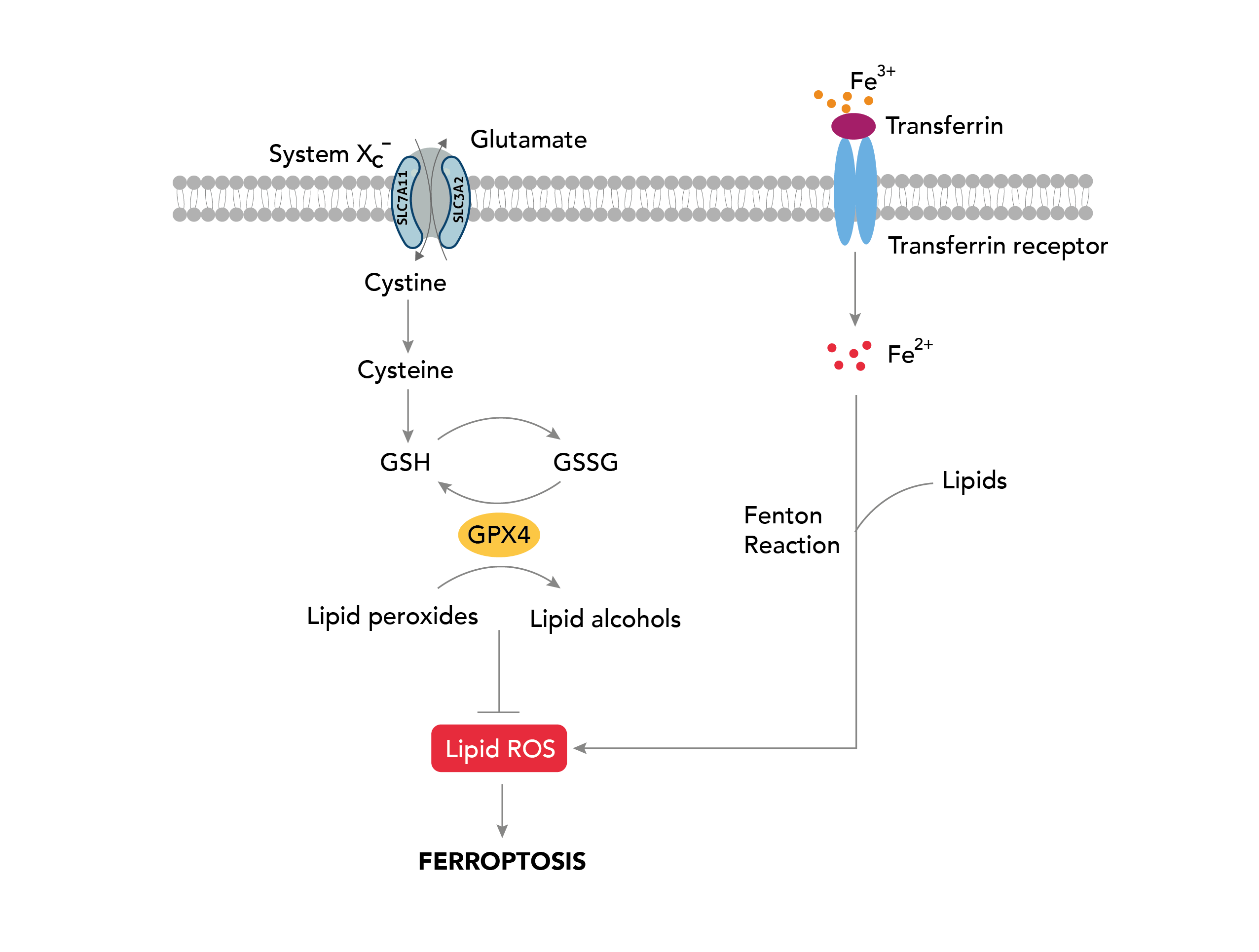
フェロトーシス(ferroptosis)は、アポトーシス(apoptosis)、ネクローシス(necrosis)、オートファジー性細胞死(autophagy-dependent cell death)とは異なる経路をたどる、近年発見されたプログラム細胞死(制御された細胞死)の一形態です。フェロトーシスは細胞内に鉄イオンと過酸化脂質が蓄積することを特徴とし、酸化的損傷が生じることにより、最終的には細胞膜の崩壊に至ります。フェロトーシスという名称は、ラテン語で鉄を意味する「ferrum」に由来します。
酸化ストレス、代謝ストレス、栄養欠乏状態等の様々な細胞ストレスがフェロトーシスの引き金となる可能性があります。これらの要因により、還元型グルタチオン(GSH:Glutathione-SH)等の細胞内の抗酸化物質の枯渇が誘発されます。還元型グルタチオンレベルが低下すると、細胞は細胞膜脂質である多価不飽和脂肪酸(PUFA:polyunsaturated fatty acid)の酸化といった、脂質酸化の影響を受けやすくなります[1]。リポキシゲナーゼ(LOX:Lipoxygenase)は、必須の補因子である鉄イオンを利用して過酸化プロセスを触媒する脂質酸化酵素であり、過酸化脂質を生成します[2、3]。過酸化脂質が代謝・分解されると、マロンジアルデヒド(MDA:malondialdehyde)や4-ヒドロキシノネナール(4-HNE:4-hydroxynonenal)等の毒性を示す代謝産物が生じます。これらの脂質過酸化反応による代謝産物の蓄積が原因となり、活性酸素種(ROS:Reactive oxygen species)の産生が亢進して細胞死が誘発されます。さらに、フェロトーシスはミトコンドリア内膜の膜電位の変化やミトコンドリアの形態の変化等のミトコンドリア機能障害とも関連することが知られています。ミトコンドリアで産生される活性酸素種(ROS)とミトコンドリアにおける脂質過酸化はフェロトーシスで重要な役割を果たすことが示唆されています[4]。フェロトーシスの生理学的役割はまだ十分に解明されていませんが、以下に示すように、様々なヒト疾患に関与していると考えられます。
プロテインテックは、フェロトーシス経路関連タンパク質の研究用製品を販売しています。「フェロトーシスエッセンシャル抗体キット(Ferroptosis Essentials Antibody Kit)」および「フェロトーシスエクスパンド抗体キット(Ferroptosis Expanded Antibody Kit)」は、フェロトーシスに関連する新規プロジェクトの開始時、複数ターゲットのスクリーニング、複数抗体購入時のコスト削減に最適なサンプラーキット(トライアル抗体パック)です。
がん
フェロトーシスの役割は、がん関連分野で最も盛んに研究されています。フェロトーシスには、腫瘍促進作用と抗腫瘍作用の両方があることが報告されています。例えば、がんの進行を妨げる免疫細胞の細胞死を促進することで腫瘍増殖に寄与する可能性があります。また、フェロトーシス発生過程における活性酸素種(ROS)産生の増加は、腫瘍細胞の増殖に寄与する可能性があります。
一方、がん細胞は無秩序な細胞増殖を維持するために代謝活性が亢進しており、鉄イオンや活性酸素種(ROS)レベルが上昇している場合があります。鉄イオンや活性酸素種(ROS)レベルが上昇している場合、細胞は特にフェロトーシスを生じやすくなります。いくつかの研究でがん細胞にフェロトーシスを誘導することは、周辺の正常細胞を傷害することなく、選択的にがん細胞を死滅させる効果的な方法となり得る可能性が示されています。有望なアプローチの1つは、GPX4(Glutathione peroxidase 4、グルタチオンペルオキシダーゼ4)と呼ばれるタンパク質を標的にする方法です。GPX4は、脂質の過酸化を防ぎ、フェロトーシスから細胞を保護するために必須の酵素です。この試みは動物実験で有望な結果が得られており[5]、現在はヒトの様々な種類のがんを対象に評価が進められています。
またフェロトーシスは、シスチン/グルタミン酸アンチポーター(Cystine/glutamate transporter、antiporter)であるSLC7A11/xCT(Solute carrier family 7A11、System xc- transporter-related protein)による調節を受けます。SLC7A11/xCTは細胞外のシスチン(Cystine)の取り込みを媒介し、細胞内に取込まれたシスチンはシステイン(Cysteine)に還元されます。システインが前駆体として利用されることでグルタチオン(GSH)が生合成され、細胞は酸化ストレスから保護されます[6]。SLC7A11/xCTの過剰発現はがん細胞に抵抗性をもたらすことが知られています[7]。SLC7A11/xCTをターゲットとしてフェロトーシスを誘導する治療戦略には、スルファサラジン(Sulfasalazine)、エラスチン(Erastin)、ソラフェニブ(Sorafenib)、HG106(SLC7A11阻害剤)等の、シスチンの取り込みを阻害する薬剤が挙げられます。フェロトーシスを誘導する低分子物質は主に2種類のクラスに分類されます。前述の薬剤は、SLC7A11/xCTを介する機構に作用し、クラス1(system X c- inhibitors)に分類されます。また、GPX4の活性を阻害する薬剤はクラス2(GPX4 inhibitors)に分類されます。ソラフェニブおよびスルファサラジンは、それぞれ腎細胞癌等を適応症とする分子標的薬、炎症性腸疾患・関節炎等を適応症とする低分子医薬品としてFDAの承認を受けており、腫瘍増殖を抑制することが知られるとともに、フェロトーシス誘導効果が報告されている薬剤です。しかし、スルファサラジンを用いた試験では有効性の欠如等が報告されており[8]、またソラフェニブは様々なキナーゼを阻害するマルチキナーゼ阻害剤のためオフターゲット作用が懸念されます。現在はSLC7A11/xCTを介した経路等、がん細胞における代謝異常の制御的影響に着目した、代謝脆弱性を標的とする薬剤の研究開発・機構解明が進められています。
がん研究分野における非常に大きな目標の1つは、がん抑制タンパク質であるTP53(TP53:Tumor protein p53)が細胞の腫瘍化を抑制する働き・仕組みを解明することです。注目すべき点は、細胞周期停止/細胞増殖停止、老化、アポトーシス性細胞死を誘導できないp53のアセチル化欠損変異体を発現する場合であっても、活性酸素種(ROS)産生時におけるフェロトーシス誘導能は完全に保持されていることです[9]。この研究では、p53がSLC7A11/xCTの転写を抑制することで、フェロトーシスを部分的に制御する可能性が示唆されました。しかし、この研究はp53の脂質過酸化制御への関与についてごく一部を明らかにしたに過ぎません。このような発見により、p53を介して生じるフェロトーシスの機構や、p53変異を有するがんにおけるその影響が研究され始めています。
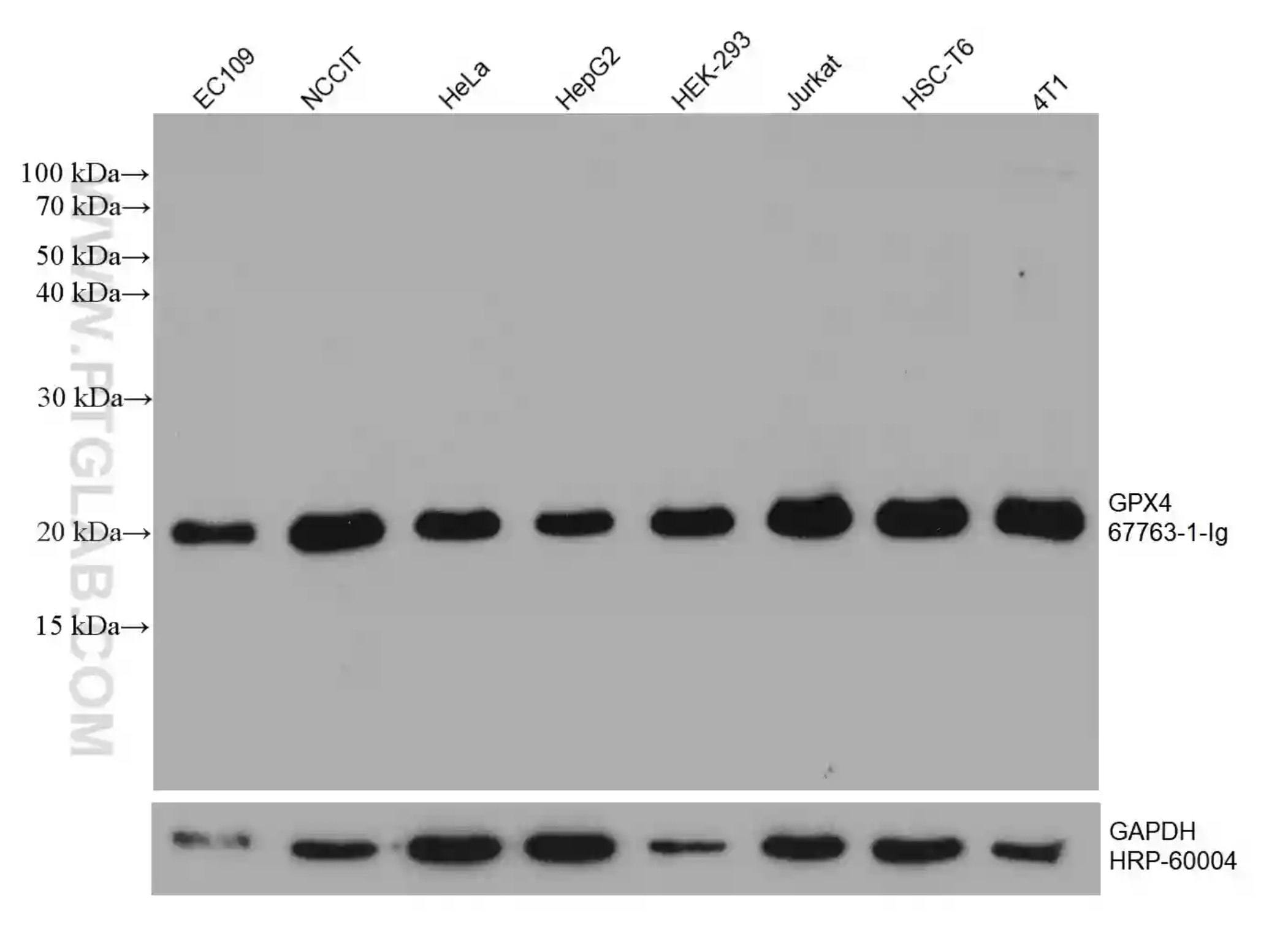
GPX4モノクローナル抗体
GPX4抗体(カタログ番号:67763-1-Ig)を使用した様々な細胞ライセートのウェスタンブロット(WB:Western blot)解析 |
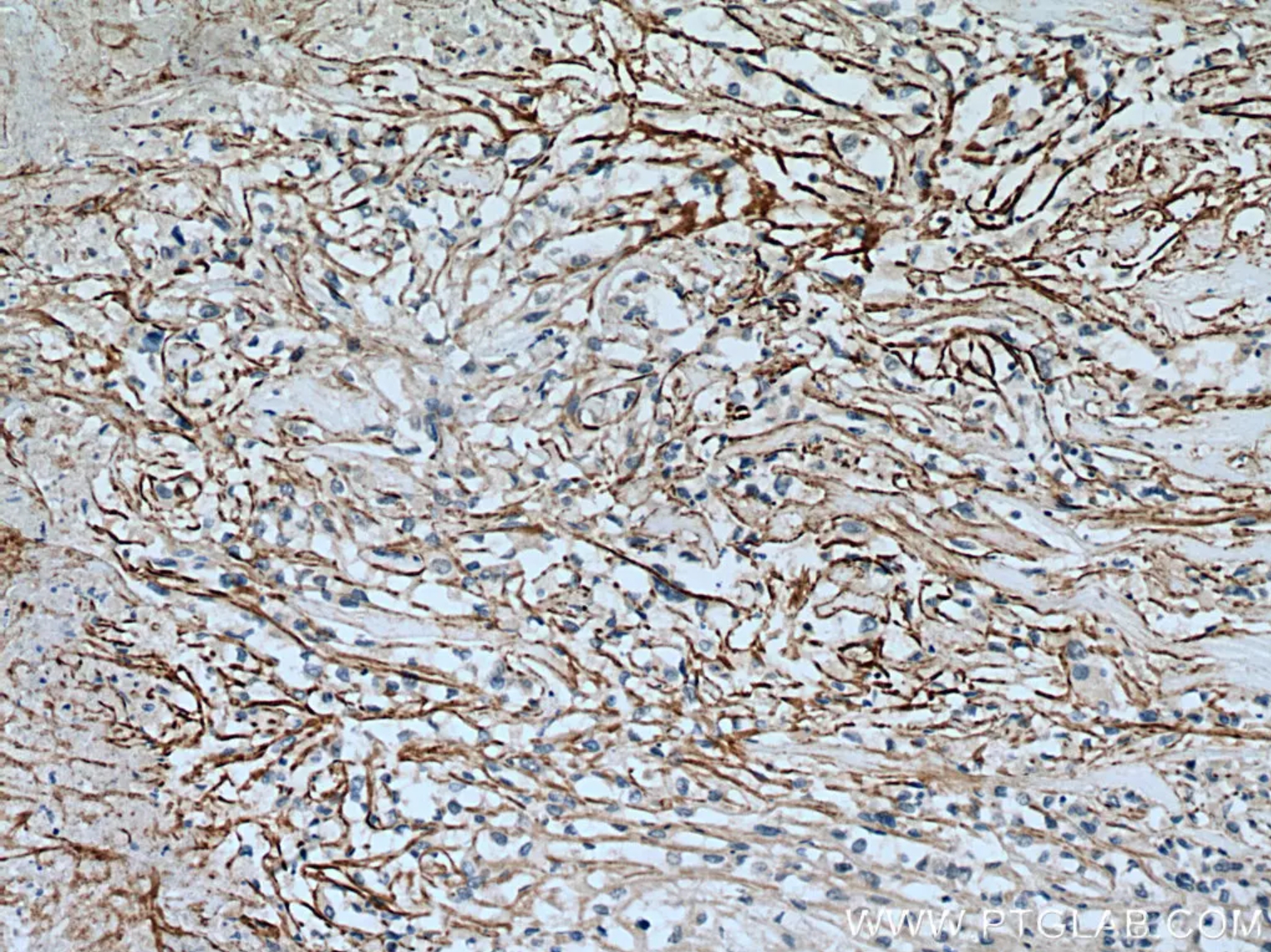
GPX4モノクローナル抗体
SLC7A11/xCT抗体(カタログ番号:26864-1-AP)を使用したヒト腎臓細胞癌の免疫組織化学染色(IHC:Immunohistochemistry) |
神経変性疾患
フェロトーシスは、アルツハイマー病(AD:Alzheimer’s disease)、パーキンソン病(PD:Parkinson’s disease)、ハンチントン病(HD:Huntington’s disease)等の様々な神経変性疾患に関与することが示唆されています。
アルツハイマー病患者では、大脳の海馬および皮質における鉄イオンレベルの上昇と脂質過酸化物の蓄積が観察されます。パーキンソン病では、ドーパミン作動性ニューロンの酸化ストレスと鉄イオンレベルが高い状態がフェロトーシスに関連付けられています。同様に、ハンチントン病患者の脳では鉄イオンの蓄積量が多いことが認められており、ハンチントン病の動物モデルではフェロトーシスが神経細胞の変性に関与していることが示唆されています[10]。
虚血性障害
心筋梗塞や脳卒中等の虚血再灌流(I/R、ischemia-reperfusion)障害は、主として全身性炎症や再灌流後の活性酸素種(ROS)産生のバースト、細胞死による臓器損傷を伴います。アポトーシス、ネクローシス、オートファジー性細胞死やその他の細胞死と関連する虚血再灌流障害の治療法が研究されている一方で、現在適用可能な治療法には多くの課題が残っています[17、18]。そのため、虚血再灌流障害におけるフェロトーシスを標的にした治療法の開発やメカニズムの解明へ向けた研究が近年盛んに行われています。フェロスタチン‐1(Fer-1:Ferrostatin-1、フェロトーシス阻害剤)やデクスラゾキサン(DXZ:Dexrazoxane、鉄キレート剤)による治療は、虚血再灌流誘発性の心筋マーカー値の上昇を防ぎ、心筋梗塞サイズを縮小することが示唆されています[19]。また、フェロトーシスにおいて重要な役割を果たすグルタミノリシス(グルタミン分解経路)を阻害すると、虚血再灌流関連性の心臓損傷が緩和されることが示されています[20]。
腎臓病
フェロトーシスは、急性腎障害(AKI:Acute kidney injury)や慢性腎障害(CKD:Chronic kidney disease)の病態形成に関与することが示唆されています。急性腎障害では、酸化ストレスと脂質過酸化が腎尿細管細胞の損傷と細胞死の一因となる可能性があります[11、12]。慢性腎臓病患者では鉄イオンの蓄積と脂肪沈着が認められ、腎臓におけるフェロトーシスの誘導が腎線維化と疾患の悪化を引き起こすことを示唆しています[13、14]。
肝臓病
フェロトーシスは、非アルコール性脂肪性肝疾患(NAFLD:Non-alcoholic fatty liver disease)、アルコール性肝障害(ALD:Alcoholic liver disease)等の肝臓病の病態形成においても重要な役割を果たすことが示唆されています。こうした肝臓病では、多くの場合肝臓に鉄イオンが蓄積して肝細胞は細胞死に至ります。非アルコール性脂肪性肝疾患やアルコール性肝障害の動物モデルでは、フェロトーシスを阻害することによって肝障害に対する保護作用を示すことが報告されています[15、16]。
ヒト疾患におけるフェロトーシスの果たす役割のエビデンスが増加しているにもかかわらず、フェロトーシスとその根本的なメカニズムは未だにその多くが解明されていません。研究者はフェロトーシスという細胞死の形態において重要な役割を果たす中心的な機構や因子の研究を継続しています。フェロトーシス研究が進展すれば、フェロトーシスの機構を利用した様々なヒト疾患の新たな治療法の開発につながる可能性があります。
参考文献
1. J Y Cao, S J Dixon. Mechanisms of ferroptosis. Cell Mol Life Sci. 2016 Jun;73(11-12):2195-209.