複数の標識色素を使用して免疫染色するための5つのヒント
多重免疫染色法は、同一試料中の2つ以上の異なる抗原の発現や共局在を研究するために、別々の抗原を検出する抗体を組み合わせる手法です
なぜ、複数の抗原を染色するのか?
—単一組織や単一細胞試料内の複数の抗原の局在について、全体像を得るため。
—試料中の異なる細胞集団を識別するため(タイムスケール実験)。
—共局在を調べるため。例えば、Tリンパ球の活性状態を確認するために、1度で細胞マーカーや活性化マーカーを染色することができる。
—貴重な組織切片や細胞を無駄にしないため。
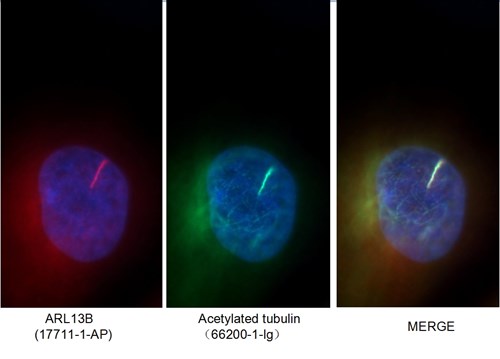
図1. アセチル化Tubulin(Lys40)抗体(カタログ番号:66200-1-Ig、希釈倍率1:50)と、Alexa Fluor 488標識AffiniPure ヤギ抗ウサギIgG(H+L)抗体を使用したMDCK細胞の免疫蛍光染色像。
多重染色を成功させるためには、実験を実施する前に以下のヒントの検討を推奨します。
ヒント1:顕微鏡の設定
使用する顕微鏡に精通することが非常に重要となります。特に、顕微鏡の発光/励起/ダイクロイックフィルターの設定、共焦点顕微鏡の場合はレーザーラインの設定等を調べておきましょう。
—蛍光色素/顕微鏡の適合性について、スペクトルビューアーや蛍光色素リファレンスチャートを確認して設定しましょう。これにより、蛍光標識抗体の最大励起波長および最大発光波長を検討することができます。
FITC/TRITCフィルターのような特定のフィルターの場合、フィルター名は共に使用する蛍光色素名に関連付けて命名されているため、互換性の評価は極めて容易です。例として、Alexa Fluor® 488は、おおよその最大励起波長(nm)に基づき命名されており、レーザーやフィルター選択用の簡潔な手引きとなり得ます。
ヒント2:適切な蛍光色素を選択する—個々の検出チャンネル間のクロスリアクションを避ける方法
1. 分子吸光係数(ε)の高い蛍光色素を選択する
蛍光色素の明るさに影響を与える最も重要な要因の1つが吸光係数であり、分子吸光係数の値が大きいほど蛍光色素の明るさは明るくなります。
2. 量子収率(Φ)の高い蛍光色素を選択する
量子収率は、蛍光の発光効率(Φ)の測定値で、放出された光子数を吸収された光子数で割ったものです。一般的に、蛍光の発光効率が100%の場合、量子収率は1(量子収率の取り得る最大値)となります。
3. 光退色感受性の高い蛍光色素を避ける
光退色とは、蛍光シグナルの強度が低下する光化学的な変性プロセスです。
注記:このような蛍光色素の場合、励起光の強度/暴露時間を短くする、あるいは退色防止試薬を含む封入剤を使用します。
4. 蛍光色素による染色が対比染色色素のスペクトルと異なることを確認する
注記:対比染色によりバックグラウンドとのコントラストが得られ、観察する染色の視覚化を補助します(例:DAPIは核を染色します)。
注記:対比染色と蛍光色素染色を容易に区別できるように設定しましょう。例えば、Alexa Fluor 405やDyLight Fluor 405(図2)のような青色蛍光色素を標識した抗体を使用する場合、核対比染色をする際はDAPIよりもDraq5の方が良好な対比染色の画像を得られます。
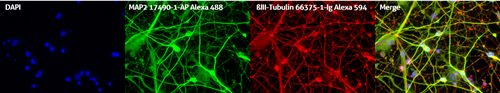
図2. MAP2抗体(カタログ番号:17490-1-AP、希釈倍率1:250)およびTUBB3抗体(カタログ番号:66375-1-lg、希釈倍率1:250)を使用した、コントロールhiPSC(ヒト人工多能性幹細胞)由来の神経細胞培養物(35日齢・4% PFAで固定)の免疫蛍光染色(赤:MAP2、緑:TUBB3、青:DAPI)。BioTalentum社(ハンガリー)より提供。
5. 蛍光多重免疫染色(IF)実験では、発光スペクトルの狭い蛍光色素を使用してスペクトルのオーバーラップを避ける
スペクトルの重複オーバーラップは、ブリードスルー(蛍光の漏れ込み)として知られており、ある蛍光色素のフィルターセットの中で認められる別の蛍光色素が検出されている状態を指します。ブリードスルーは、個別の蛍光シグナルの観測を困難にし、共局在実験の評価を煩雑にします。
注記:蛍光色素を選択する際に、スペクトルビューアーを使用して発光・励起スペクトルが重なっていないかを確認します。
—標的タンパク質の発現量に基づいて、異なるチャンネルで検出できる最適な蛍光色素を選択します。
—目的のタンパク質の発現量/発現パターンを基に、多重色素実験において、どの蛍光色素を使用してどの抗原を検出するか決定します。最も明るい蛍光色素は、最も発現量の少ない抗原を検出するために確保しておきます。最も発現量の多い抗原を検出する際は、最も暗い蛍光色素を使用します。
ヒント3:最適な多重染色法を選択する
オプション1:非標識抗体/連続インキュベーション
このオプションは、一次抗体が異なる宿主に由来し(例:抗原Aに対するマウスモノクローナル抗体、抗原Bに対するウサギポリクローナル抗体、抗原Cに対してヤギポリクローナル抗体を使用)、それらの抗体が同時インキュベーション時に凝集体を形成する場合に有用です。
オプション2:非標識一次抗体/同時インキュベーション
このオプションは、一次抗体が異なる宿主に由来(例:抗原Aに対するマウスモノクローナル抗体、抗原Bに対するウサギポリクローナル抗体を使用)する場合に有用です。
注記:ブロッキングバッファーは、二次抗体の各宿主の血清を混合して調製します。
オプション3:直接標識された一次抗体/同時インキュベーション
このオプションは、一次抗体が同じ宿主に由来(例:抗原Aに対するマウスモノクローナル抗体、抗原Bに対するマウスモノクローナル抗体を使用)する場合に有用です。
細胞の「目印」を識別するため、対比染色を活用する
対比染色は、次の2つの異なる目的で使用されます。
—バックグラウンド蛍光を軽減するため
—細胞小器官を特定し、シグナルの局在に関する情報を得るため
核対比染色に推奨されるインキュベーション条件:0.1~1μg/mLの核染色色素を使用し、室温で5分間のインキュベーションを行い、その後PBSで完全に洗浄する(図3)。
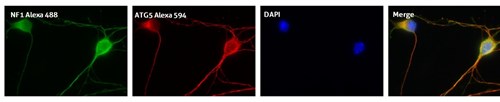
図3. 抗ATG5抗体(カタログ番号:10181-2-AP、希釈倍率1:50)を使用した、E15マウス皮質ニューロンのIFの結果(細胞:NF1抗体で共染色(緑)、40倍レンズを使用、4% PFA固定、0.2% Triton X-100で透過処理)。
封入溶剤の中には、DAPIが事前に添加されているものがあります。また、空気に触れると硬化するため、カバースリップの縁をシールする必要がないものがあります。
注記:細胞の付着したカバースリップを誤って落とし、接着サンプルの面が分からなくなってしまった場合でも、ピンセットでカバースリップを慎重に回収することで実験を継続できます。その場合は、ピペットチップでカバースリップの片面を軽くこすって細胞が取れるかどうか目視で確認してカバースリップの向きを決定し、マウントします。
ヒント4:抗体/抗体の組み合わせを選択する前に考慮すべきこと
ポリクローナル抗体は、複数の免疫グロブリンGのアイソタイプ(例:IgG1、IgG2a)の混合物を含みます。したがって、対象物を最大限に検出するには、すべてのアイソタイプを認識できる二次抗体を使用すると良いでしょう。このような抗体は、「IgG H+L」(HおよびLは、それぞれIgGの重鎖および軽鎖を表します)と記載された二次抗体を指します。この記載がある場合、二次抗体宿主は、他種由来のIgGプールを使用して免疫化されたことを意味し、精製された二次抗体は抗原全体を認識できます。
モノクローナル抗体は、免疫グロブリンの単一のアイソタイプを含みます。したがって、そのアイソタイプを特異的に認識する二次抗体を使用することが重要となります。一次抗体のアイソタイプは、製品データシートに記載されています。
最良の方法は、一次抗体はそれぞれ異なる種から作製し、使用する蛍光標識二次抗体が別々のチャンネルで検出されるようにすることです。
ヒント5:適切なコントロールを使用する
観察される蛍光が非特異的アーチファクトではなく染色の結果であることを検証するために、少なくとも4種類のコントロールを実施します。
1. 蛍光標識抗体・染色色素を使用しない非染色サンプル(自家蛍光によるバックグラウンドシグナルか確かめるため)。
2. 二次抗体のみで染色したスライドサンプル(バックグラウンドシグナルのしきい値を確かめるため)。
3. 組織/細胞の陽性・陰性コントロール。使用する組織/細胞のスライドが、対象とするエピトープを発現しているか(または発現していないか)判明していること。
4. それぞれの染色を別々に実施する(交差反応を示さず、適切に標識できているか確認するため)。
注記:サンプル全体で観察でき、最も共通して認められ、最も代表的なパターンの画像を記録します。


