胚性幹細胞(ESC)を詳しく知る―生物学的コンセプト
胚性幹細胞(ESC)は、着床前段階の胚、通常は胚盤胞段階の胚の内部細胞塊から得られます。
ESCとその簡潔な定義
胚発生初期、受精卵が分裂した細胞は相対的に未分化な状態を維持しており、体内のほぼすべての組織に分化する能力を持っています(図1)。ESCには、自己複製性(self-renewal)と多能性(pluripotency)という2つの重要な特性があり(1)、どちらの特性もin vitroのアプリケーションに広く利用されています(2)。
HumanKine®製品は、特定の細胞を培養および誘導する際の有用なツールです。
プロテインテックのHumanKine® サイトカイン&増殖因子
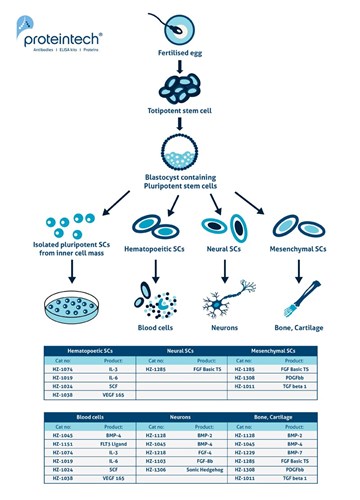
図1. 胚性幹細胞(ESC)のような多能性幹細胞は、胚盤胞の内部細胞塊(ICM:inner cell mass)が元になっている。ICM細胞は、胚体外系組織を除いて、身体のあらゆる組織に分化することができる。(3)から図を改変して引用。
胚性幹細胞(ESC):その歴史
最初のESCは、30年以上前にマウス胚盤胞のICMから単離されました(4)。これらの細胞は、多能性であり、胚盤胞ESCと呼ばれていました(5)。それ以来、着床前胚のICMをはじめ、1987年にはヒツジ(6)、1993年にはウサギ(7)、1994年にはウシ(8)、1995年にはブタ(9)、1998年にはヒト(10)、そして2008年にはラット(11)等、多くの哺乳類からESCが単離されています。また、ヒト核移植胚性幹細胞(NT-ESC:Nuclear Transfer Embryonic Stem Cell)と呼ばれる、ヒト体細胞核移植(SCNT:somatic cell nuclear transfer)胚由来のESCの他に、ヒト胚の異なる発生段階由来のESCが得られています(例:胚盤胞、桑実胚、発生停止胚盤胞、割球)(5,12)。
胚性幹細胞(ESC)の特徴
ESCは非常に独特な特徴を示すことから、疾病の根本的なメカニズムの研究、in vitroにおける細胞発生の再現実験だけでなく、組織形成や発生の再現実験、創薬スクリーニング、究極的には細胞補充療法のユニークなアプリケーションツールとなり得ます。ESCは、比較的容易に増殖可能な細胞であり、生物のあらゆる成熟細胞に分化する能力を持っています。
ESCが単離されてから数年の間に、ESCの培養に必要な条件を満たし、その誘導方法や培養方法を改良するために様々な方法が採用されてきました。実際、幹細胞を培養するにあたり、培地組成や培養条件が定められていない、あるいは不適切である場合、自発的分化が生じ実験の再現性が低下します。過去には、MEK/ERKシグナル伝達経路およびグリコーゲン合成酵素キナーゼ‐3(GSK-3:glycogen synthase kinase-3)シグナル伝達経路を阻害すると共に、LIF(leukemia inhibitory factor、白血病阻止因子)(当社取り扱いのLIFタンパク質製品はカタログ番号:HZ-1292)の添加によりStat3を活性化させると、樹立したESCの未分化状態を維持した細胞を十分に増殖できると考えられていました。(13,14)。しかし、最新の適しているとされる方法では、細胞をヘパリン結合性増殖因子であるbFGF(basic fibrosis growth factor、塩基性線維芽細胞増殖因子)(当社取り扱いのbFGFタンパク質製品はカタログ番号:HZ-1285)と共に培養しており、この方法はヒトESC(hESC)の自己複製を促進する効果が優れていることが示されています(15)。幹細胞の特性を維持するためには次のような成分が必要となります:
i. フィーダー細胞、馴化培地、サイトカイン(例:TGFβ1(カタログ番号:HZ-1011)、WNT3A(カタログ番号:HZ-1296))
ii. ヒト血清アルブミン(HSA)(カタログ番号:HZ-3001)または血清代替品
iii. マトリゲルやフィブロネクチン等のマトリックス、ラミニン(16)
幹細胞培養における異種性物質の影響(すなわち毒性タンパク質の形成、動物試料由来の病原体の混入リスク増加、発生研究の条件の複雑化)を軽減するために、アニマルフリー製品と組成が判明している培地中でのhESC株の培養について検討されています(17)。
胚性幹細胞(ESC)のアプリケーション
ESCを利用できると考えられるアプリケーションとして、心血管疾患、脊髄損傷、緑内障等が挙げられます。Shroffらの最近の研究では、脊髄損傷患者の損傷部位にhESCを移植すると、身体コントロール、姿勢制御、感覚、四肢の運動機能を改善することが示されています(18)。さらに、ESCは、インスリン分泌β細胞(GLUT2、INS1、GCK、PDX1がマーカーとなる)に直接分化することが可能で、この際にPDX1を介したエピジェネティクスリプログラミングによって分化する可能性が示唆されています(19)。
さらに、神経発生因子の過剰発現により、ヒト線維芽細胞を異なる誘導サブタイプニューロン(iNC:induced neuronal cell)に直接変換する実験も成功しています(20-23)。人工多能性幹細胞(iPSC:induced pluripotent stem cell)やiNCの作製により、in vitroの細胞モデリングや神経発生の再現実験に使用できる新たなツールが得られ、神経変性疾患の動態病理学を明らかにするだけでなく、細胞補充療法の開発にも役立つと考えられます。
総合的には、近年のhESC生物学の進歩により、幹細胞工学の分野に大きな関心が集まっています。しかし、まずは幹細胞の安全性に関する問題を克服しなければなりません。ESCを使用する上で最大の懸念事項の1つは、樹立した各ESC株が着床前胚から単離されていることの保証方法です。結果的に、この保証手順は倫理的観点からも簡単なことではなく、一部の国では禁止されている場合もあります。
参考文献
- M. H. Kaufman, et al. Establishment of pluripotential cell lines from haploid mouse embryos. J Embryol Exp Morphol. 1983 Feb;73:249-61.
- KR Boheler, et al. Differentiation of pluripotent embryonic stem cells into cardiomyocytes. Circ Res. 2002 Aug 9;91(3):189-201.
- Stem Cell Bioengineering. Science Creative Quarterly. 2004 Aug
- M.J. Evans, et al. Establishment in culture of pluripotential cells from mouse embryos. Nature. 1981 Jul 9;292(5819):154-6.
- J.A. Thomson, et al. Embryonic stem cell lines derived from human blastocysts. Science. 1998 Nov 6;282(5391):1145-7.
- A. Handyside, et al. Towards the isolation of embryonal stem cell lines from the sheep. Rouxs Arch Dev Biol. 1987 Mar;196(3):185-190.
- J.R. Giles, et al. Pluripotency of cultured rabbit inner cell mass cells detected by isozyme analysis and eye pigmentation of fetuses following injection into blastocysts or morulae. Mol Reprod Dev. 1993 Oct;36(2):130-8.
- R.A. Cherny, et al. Strategies for the isolation and characterization of bovine embryonic stem cells. Reprod Fertil Dev. 1994;6(5):569-75.
- R.W. Gerfen, M.B. Wheeler. Isolation of embryonic cell‐lines from porcine blastocysts. Animal Biotechnology. 1995;6(1):1-14.
- J.A. Thomson, et al. Embryonic stem cell lines derived from human blastocysts. Science. 1998 Nov 6;282(5391):1145-7.
- P. Li, et al. Germline competent embryonic stem cells derived from rat blastocysts. Cell. 2008 Dec 26;135(7):1299-310.
- A. Warmflash, et al. A method to recapitulate early embryonic spatial patterning in human embryonic stem cells. Nat Methods. 2014 Aug;11(8):847-54.
- Q.L. Ying, et al. The ground state of embryonic stem cell self-renewal. Nature. 2008 May 22;453(7194):519-23.
- A. Czechanski, et al. Derivation and characterization of mouse embryonic stem cells from permissive and nonpermissive strains. Nat Protoc. 2014 Mar;9(3):559-74.
- R.H. Xu, et al. BMP4 initiates human embryonic stem cell differentiation to trophoblast. Nat Biotechnol. 2002 Dec;20(12):1261-4.
- K.R. McEwen, et al. The impact of culture on epigenetic properties of pluripotent stem cells and pre-implantation embryos. Biochem Soc Trans. 2013 Jun;41(3):711-9.
- K. Rajala, et al. Testing of nine different xeno-free culture media for human embryonic stem cell cultures. Hum Reprod. 2007 May;22(5):1231-8.
- G. Shroff, R. Gupta. Human embryonic stem cells in the treatment of patients with spinal cord injury. Ann Neurosci. 2015 Oct;22(4):208-16.
- C. Salguero-Aranda, et al. Differentiation of Mouse Embryonic Stem Cells toward Functional Pancreatic β-Cell Surrogates through Epigenetic Regulation of Pdx1 by Nitric Oxide. Cell Transplant. 2016 Oct;25(10):1879-1892.
- M. Caiazzo, et al. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 2011 Jul 3;476(7359):224-7.
- E.Y. Son, et al. Conversion of mouse and human fibroblasts into functional spinal motor neurons. Cell Stem Cell. 2011 Sep 2;9(3):205-18.
- A.S. Yoo, et al. MicroRNA-mediated conversion of human fibroblasts to neurons. Nature. 2011 Jul 13;476(7359):228-31.
- Y. Liu, et al. Leukemia inhibitory factor promotes nestin-positive cells, and increases gp130 levels in the Parkinson disease mouse model of 6-hydroxydopamine. Neurosciences (Riyadh). 2013 Oct;18(4):363-70.

