ドットブロット法によるRNAメチル化修飾の検出
抗体を用いたRNAドットブロット法について、プロテインテックの研究者がその手順を解説します。
プロトコールへジャンプする
RNAドットブロット法とは?
RNAドットブロット(RNA dot blot、RNA dot blotting)法とは、メンブレン上に滴下されたRNAサンプルを適切なプローブを用いて半定量的に検出する手法です。特定配列を持つRNAの検出だけではなく、メチル化修飾等のRNA修飾を検出したい場合にもRNAドットブロット法を適用することができます。
RNAドットブロット法の原理
RNAドットブロット法のプロトコールは、RNAサンプルを電気泳動によって分離しないという点を除き、ノーザンブロッティング(Northern blotting)と同じ手順です。電気泳動を実施せず、抽出したRNAをニトロセルロース(NC)メンブレンまたはナイロンメンブレンにスポットします。続けて標的RNA配列特異的な放射性同位元素(RI)標識核酸プローブをハイブリダイゼーションすることで特定配列を持つRNAを検出します。また、RI標識核酸プローブの代わりに一次抗体と二次抗体をインキュベーションする従来の手法を適用することもできます。例えば、メチル化RNA修飾等に特異的な抗体を用いることでRNA転写後修飾を検出することが可能です。
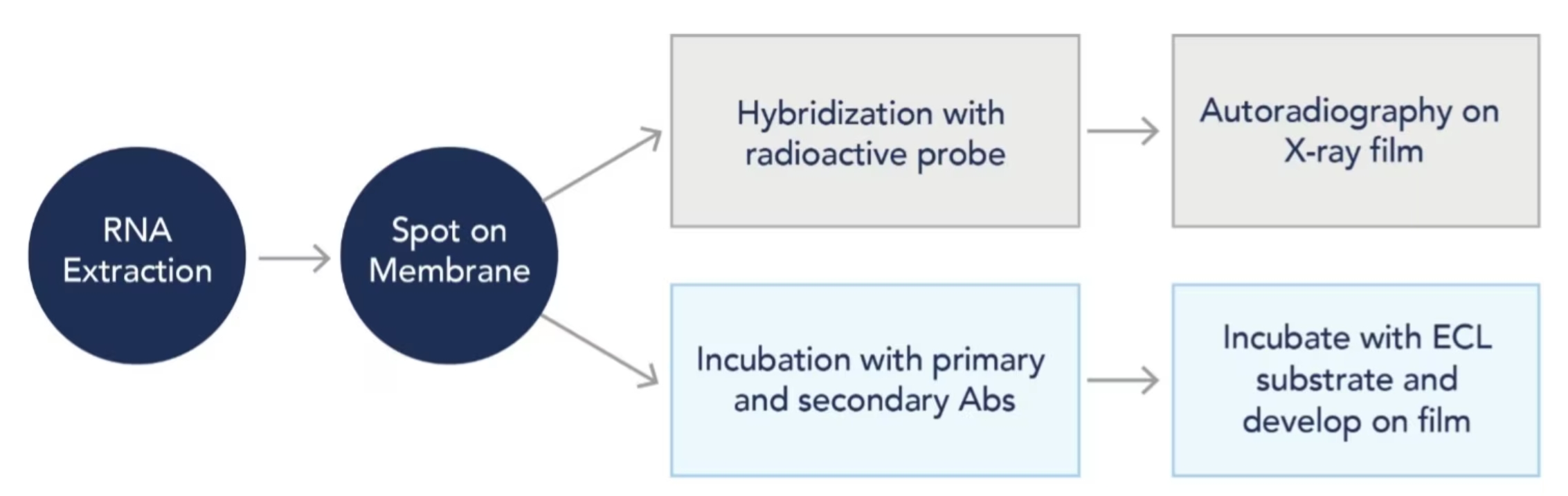
図1. RNAドットブロット法のプロトコールの概略
RNAドットブロット法がメチル化RNA修飾の観察に適している理由
RNAメチル化とは、RNA中の特定のヌクレオチドの官能基がメチル基(-CH3)へと変化するRNA転写後修飾です。RNA転写後修飾は、RNAの安定性や遺伝子発現、発生や分化、疾患等の多くの生物学的プロセスにおいて極めて重要な役割を果たします。N6-メチルアデノシン(m6A)修飾は、真核生物において最もよく生じるRNA修飾です。その他のRNAメチル化修飾としては、N1-メチルアデノシン(m1A)修飾、5-メチルシトシン(m5C)修飾、7-メチルグアノシン(m7G)修飾等が挙げられます。
メチル化RNA分子を認識する抗体を使用するドットブロット法は、以下の特長を持つためRNAメチル化を解析するための強力なツールとなります。
感度:多くの場合、抽出RNA中に存在するメチル化RNAは微量であるため、メチル化RNAを検出するには感度の高い手法が求められます。ドットブロット法は感度が高く、極めて低レベルのメチル化RNAを検出することが可能です。
操作:ドットブロット法は、RNAシーケンス解析やその他の複雑な技術を必要としないため、コスト効果に優れた効率的なメチル化RNA修飾検出の選択肢となります。サンプルの前処理も用意する機器も最小限で済む比較的単純な手法です。
特異性:特異性の高さは、メチル化RNAをその他の転写後修飾、あるいはRNA分解産物と区別するうえで重要です。目的のメチル化RNAに特異的な抗体またはプローブを使用した場合、ドットブロットは極めて特異的に目的RNAを検出できる手法です。
ハイスループット解析:ドットブロット法は、手軽に多数のサンプルのハイスループットスクリーニングに適用することができます。そのため様々な生物学的コンテクストにあるRNAメチル化のラージスケール研究に有用な技術です。
なおドットブロット法は半定量的な手法であり、RNA修飾をある程度正確に定量するにはRNAシーケンシングや質量分析のような別の手法で測定する必要があることに留意してください。
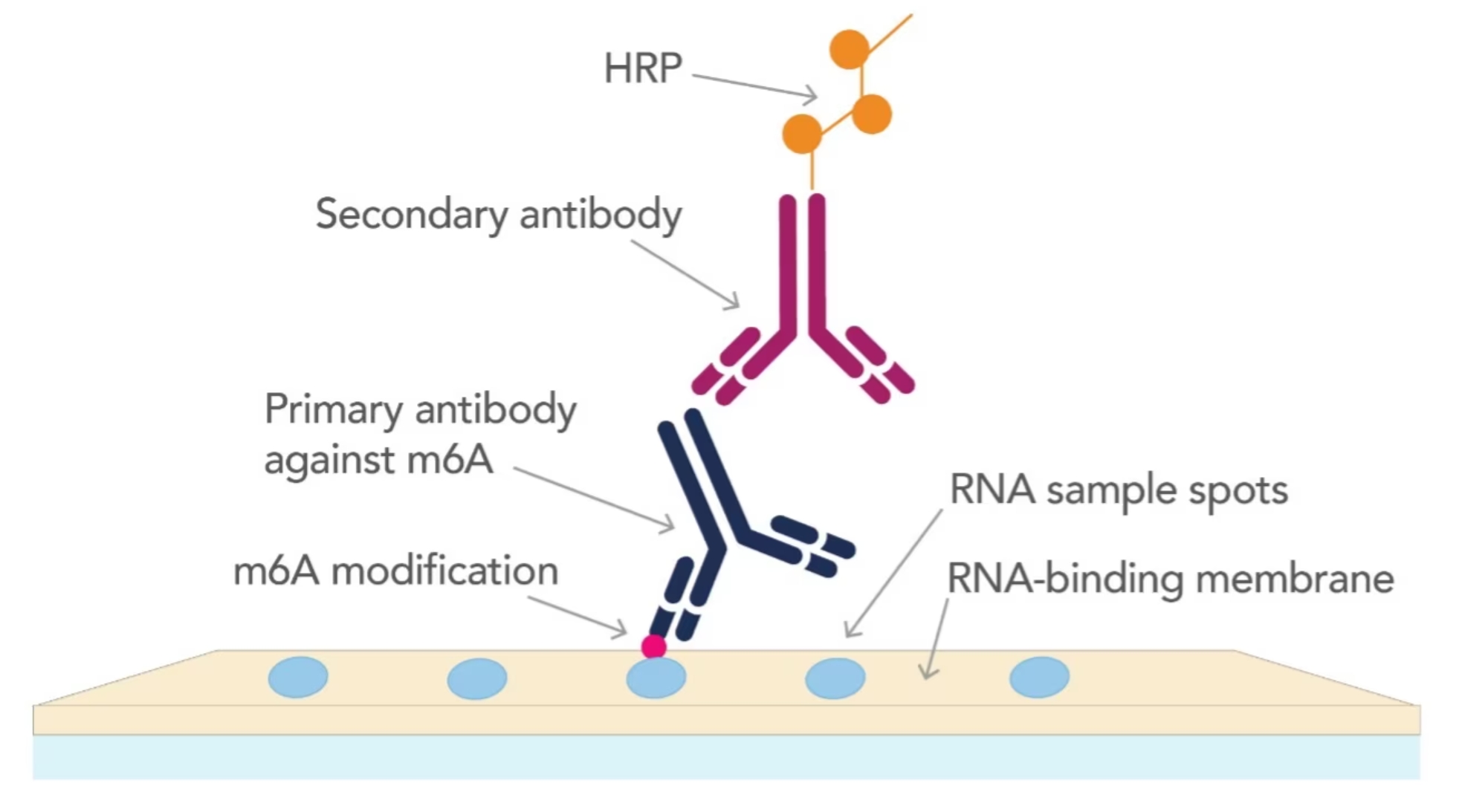
図2. ドットブロット法によるm6A修飾RNAの同定
プロテインテックはドットブロット法検証を実施した抗メチル化RNA抗体を販売しています。
m6Aモノクローナル抗体(カタログ番号:68055-1-Ig)
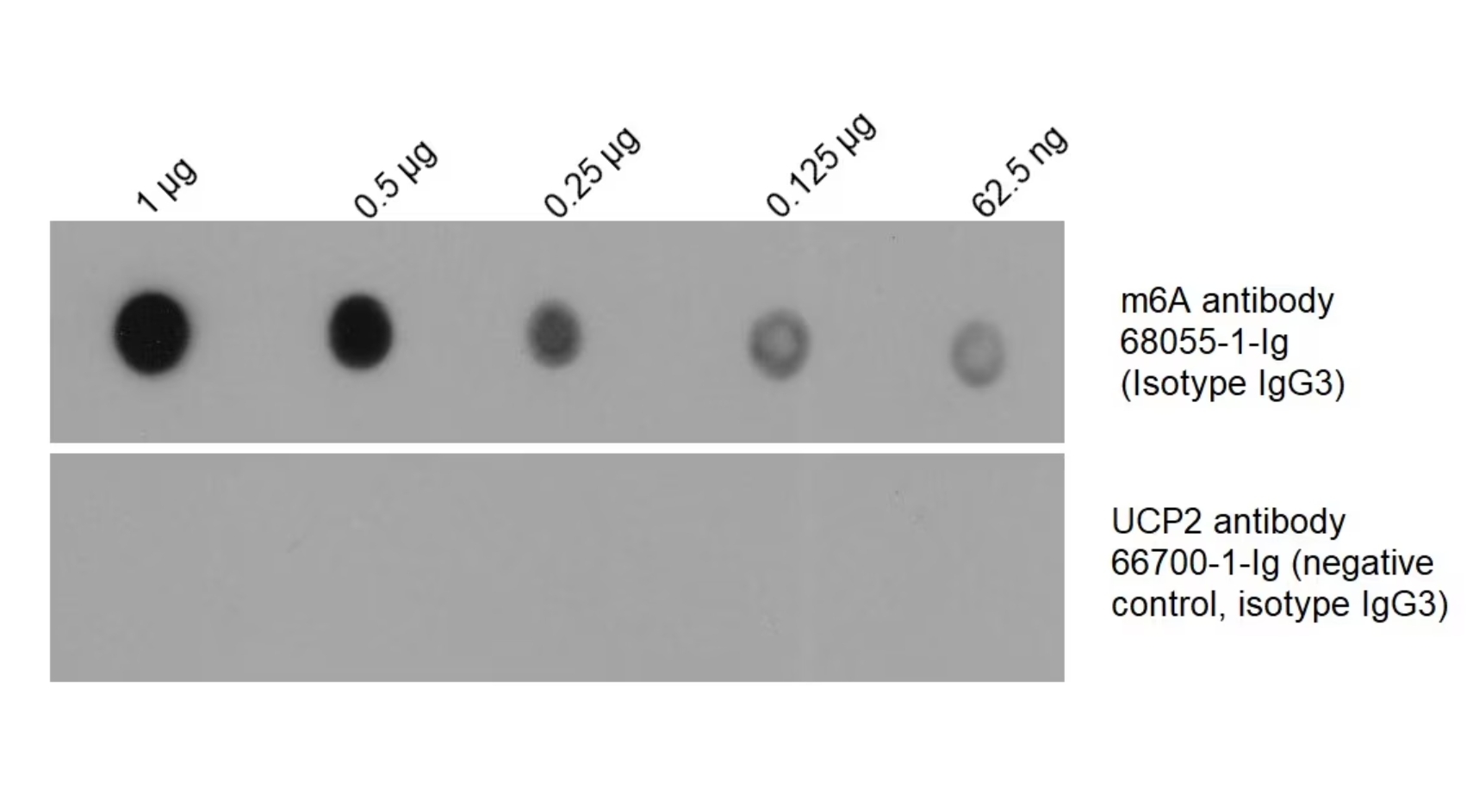
図3. HEK293細胞から全RNAを抽出し、段階希釈したRNAをニトロセルロース(NC)メンブレン上に点状に滴下した。メンブレンをm6A抗体(カタログ番号:68055-1-Ig、希釈倍率1:2000)でブロットし、HRP標識ヤギ抗マウスIgG抗体とインキュベーションした。並行して、陰性コントロールとしてm6A抗体と同一のアイソタイプ抗体(UCP2抗体、カタログ番号:66700-1-Ig)を一次抗体と同量ブロットし、二次抗体とインキュベーションした。
m5C抗体(カタログ番号:68301-1-Ig)
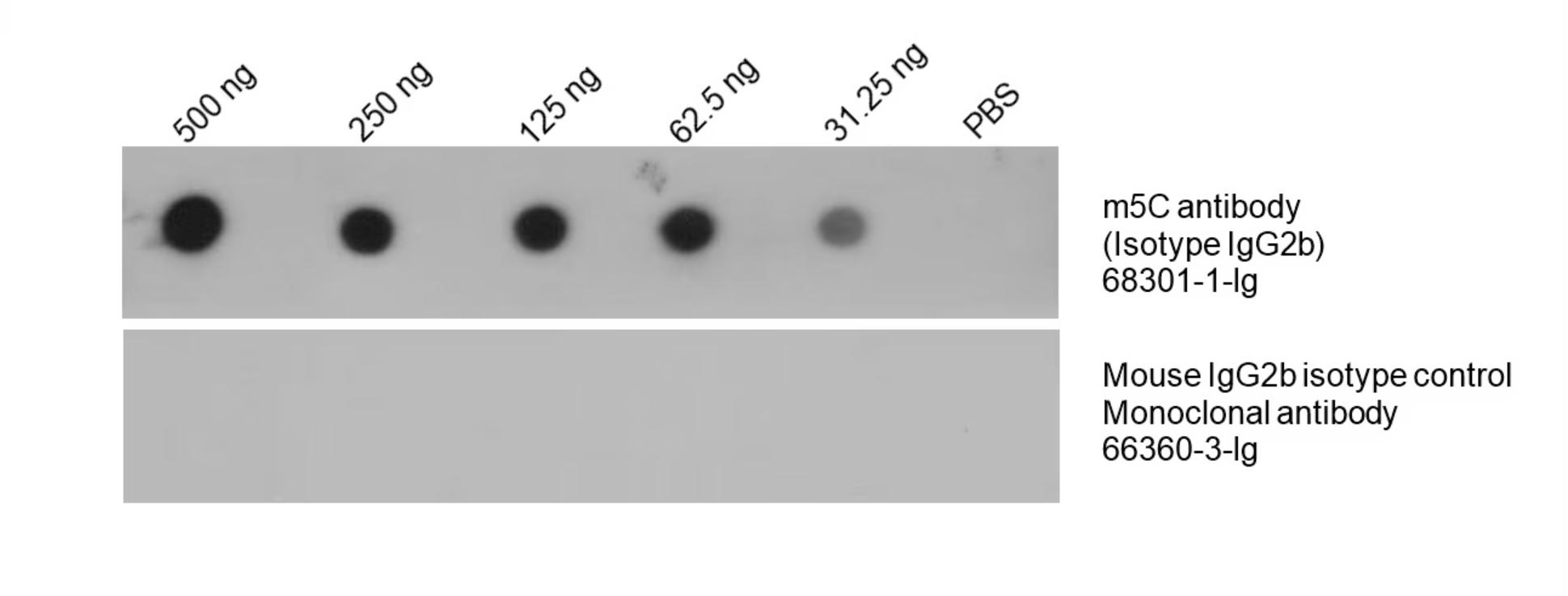 図4. HeLa細胞から全DNAを抽出し、段階希釈したDNAをニトロセルロース(NC)メンブレン上に点状に滴下した。メンブレンをm5C抗体(カタログ番号:68301-1-Ig、希釈倍率1:5000)でブロットし、HRP標識ヤギ抗マウスIgG抗体とインキュベーションした。並行して、陰性コントロールとしてm5C抗体と同一のアイソタイプ抗体であるMouse IgG2bアイソタイプコントロール抗体(カタログ番号:66360-3-Ig)を一次抗体と同量ブロットし、二次抗体とインキュベーションした。
図4. HeLa細胞から全DNAを抽出し、段階希釈したDNAをニトロセルロース(NC)メンブレン上に点状に滴下した。メンブレンをm5C抗体(カタログ番号:68301-1-Ig、希釈倍率1:5000)でブロットし、HRP標識ヤギ抗マウスIgG抗体とインキュベーションした。並行して、陰性コントロールとしてm5C抗体と同一のアイソタイプ抗体であるMouse IgG2bアイソタイプコントロール抗体(カタログ番号:66360-3-Ig)を一次抗体と同量ブロットし、二次抗体とインキュベーションした。
m7G抗体(カタログ番号:68302-1-Ig)

図5. HeLa細胞から全RNAを抽出し、段階希釈したRNAをニトロセルロース(NC)メンブレン上に点状に滴下した。メンブレンをm7G抗体(カタログ番号:68302-1-Ig、希釈倍率1:5000)でブロットし、HRP標識ヤギ抗マウスIgG抗体と共にインキュベーションした。並行して、陰性コントロールとしてm7G抗体と同一のアイソタイプ抗体であるMouse IgG2bアイソタイプコントロール抗体(カタログ番号:66360-3-Ig)を一次抗体と同量ブロットし、二次抗体とインキュベーションした。
抗メチル化RNA抗体を使用したRNAドットブロット法のプロトコール
- RNA抽出試薬またはRNA抽出キットを使用してサンプルから抽出したRNAを、最終濃度が0.05~2 µg/µlになるよう調製します。濃度が高い場合はPBSで希釈します。RNaseのコンタミネーションが生じないように注意してください。
- 抽出RNAをニトロセルロース(NC)メンブレンに直接点状に滴下します。滴下位置とメンブレンの裏表がわかるように印をつけます。各ポイントにはRNA量が0.2~2 µg程度になるようサンプル溶液を滴下します。最適なRNA量を決定するために段階希釈したRNA溶液の調製を推奨します。必要に応じてRNA溶液をPBSで希釈し、各ポイントへ滴下する体積が等しくなるよう調製してください。
- メンブレンを室温で5~15分間乾燥し、1% BSA(PBSTで調製)で1時間ブロッキング処理します。ローディングコントロールとして核酸染色用のメチレンブルーを使用する場合は、乾燥メンブレンをブロッキング処理せずに染色します。ブロッキング処理は、メチレンブルー染色に干渉するおそれがあります。
- メンブレンをPBS、PBST、TBST等で軽く1回洗浄します。一次抗体を1% BSA(PBSTで調製)溶液で希釈します。プロテインテックの抗メチル化RNA抗体の推奨希釈倍率は以下の通りです。
m6A抗体(カタログ番号:68055-1-Ig) 希釈倍率1:2000
m5C抗体(カタログ番号:68301-1-Ig) 希釈倍率1:5000
m7G抗体(カタログ番号:68302-1-Ig) 希釈倍率1:5000
希釈した一次抗体溶液をメンブレンに添加し、室温で1.5時間インキュベーションします。一次抗体溶液がメンブレンを完全に覆うように注意します。なお希釈溶液にはスキムミルクを使用しないでください。
- メンブレンをPBSTで5分間洗浄する作業を4回繰り返します。洗浄バッファーを捨て、1% BSA溶液に希釈した二次抗体を添加し、室温で1.5時間または37℃で1時間インキュベーションします。二次抗体がメンブレンを完全に覆うように注意します。なお希釈溶液にはスキムミルクを使用しないでください。
- メンブレンをPBSTで5分間洗浄する作業を4回繰り返します。洗浄バッファーを完全に取り除き、ECL基質を添加して発色させます。


