消化器系に対するCOVID-19の長期的影響
Rahul Panchal著(Scientist II、プロテインテックグループ、米国イリノイ州シカゴ)
新型コロナウイルス感染症(COVID-19)後の胃腸障害は、感染の罹患後症状(Long COVID)としてかねてより確認されています。本稿では、炎症亢進により消化器症状が引き起こされる代表的なメカニズムについて詳述し、一連の研究に役立つプロテインテック製品を紹介します。
※本稿では、以下の英文記事を日本語訳して掲載しています。
https://www.ptglab.com/news/blog/long-term-effects-of-covid-19-on-the-gastrointestinal-system/
COVID-19は腸の炎症に関与します。
腸組織には高いレベルでACE2受容体(アンジオテンシン変換酵素II、コロナウイルス受容体)が発現しているため、消化器系は新型コロナウイルス(SARS-COV-2)のターゲットとなる可能性があります。ウイルスがACE2受容体と結合することで、アンジオテンシンⅡをアンジオテンシン(1-7)に変換する作用が阻害されます。正常な状態においてアンジオテンシン(1-7)は抗炎症状態の促進に働くため、アンジオテンシンⅡからアンジオテンシン(1-7)への定常的変換は重要です。しかし、ACE2受容体にSARS-COV-2が結合すると、アンジオテンシンⅡの蓄積により、NAPDH活性の亢進、血栓形成因子の増加、血管収縮傾向、炎症促進性サイトカインの亢進を原因とする炎症促進状態に陥ります。
通常、COVID-19の腸感染は免疫細胞の動員や活性化につながります。腸管細胞でのCCL25の高発現は、CCR9-CD4+T細胞の動員を誘発します。SARS-CoV-2感染後、急性期を過ぎてから数か月に及ぶ遷延症状は、血清中のインターフェロンやケモカイン濃度の上昇の他に、PD1+ CD8+/TIM3+ CD8+メモリーT細胞やCD86+ CD38+形質細胞様樹状細胞等の活性化免疫細胞の増加との関連性が示唆されています。こうした免疫細胞が増加した状態は、感染後8か月でも認められる場合があります。このような免疫細胞は血液やリンパ系を循環しながら、IL1-β、IL-6、TNF-α等の炎症促進性サイトカインを高いレベルで産生・分泌します。
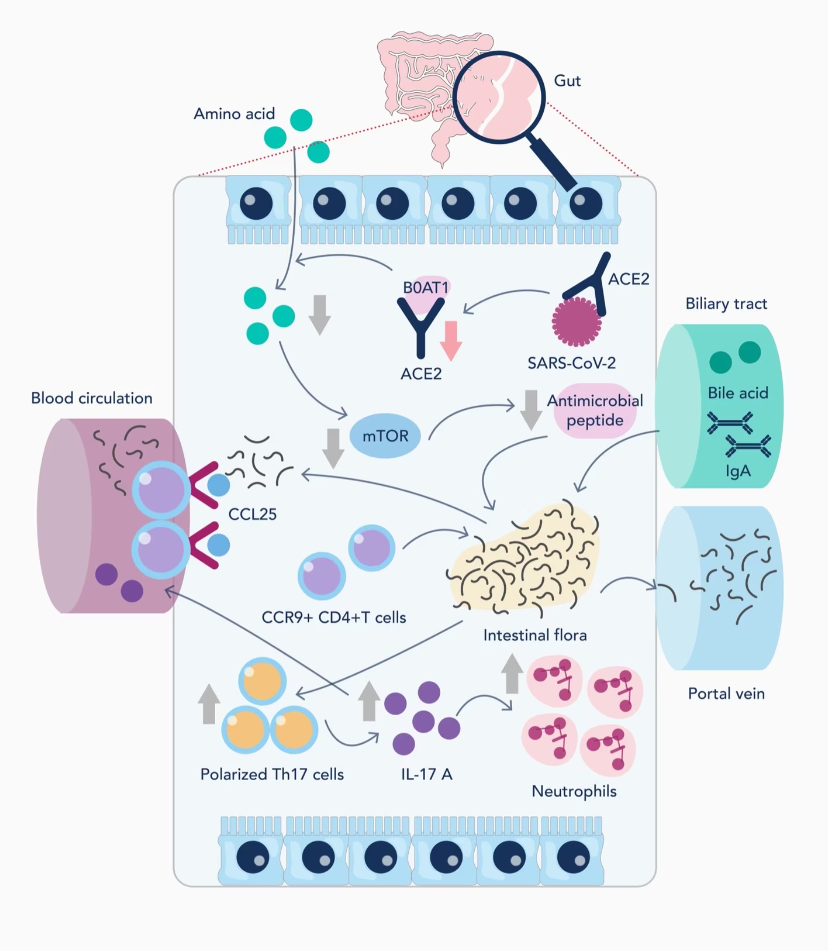
SARS-COV-2に感染した際の消化管の炎症メカニズム(図はYe et al., 2020より引用)。
COVID-19とマイクロバイオーム
加えて、COVID-19に感染することで消化管内のマイクロバイオームの均衡が崩壊し、消化器症状に影響を及ぼすことを示唆するエビデンスも存在します。通常、正常なマイクロバイオームは炎症促進性サイトカインの働きを抑制し、タイトジャンクションタンパク質の発現上昇や粘液産生の増加を介して、腸管バリアの完全性を促進します。腸内マイクロバイオームの崩壊は、CCR9-CD4+T細胞の動員によって引き起こされる可能性があります。さらに、SARS-COV-2がACE2受容体と結合することによって、ACE2受容体と結合するB0AT1輸送体の働きが阻害されます。このB0AT1輸送体は膜貫通タンパク質であり、細胞膜を介してトリプトファン等のアミノ酸を輸送します。腸管細胞によるトリプトファンの吸収は、腸内微生物の恒常性調節に働く抗菌ペプチドの産生を増加させるシグナル経路を促進します。トリプトファンがB0AT1にアクセスすることができず細胞内に吸収されない場合、抗菌ペプチドの分泌の減少や細菌叢の不均衡が生じます。このような状態は、炎症促進性サイトカインの増加や腸管バリア強度の低下と関連することが示唆されています。腸管バリアの完全性の損失は、腹痛や下痢等の急性期後症状の原因になる可能性があります。
プロテインテックの関連製品
免疫細胞マーカー
ターゲット |
| CD14 |
| CCR9/ACKR2 |
| CD86 |
| CD38 |
| CD4 |
| CD8 |
| CD16 |
| PD1 |
| TIM3 |
分泌サイトカイン
ターゲット |
| IL-1 beta |
| IL-6 |
| TNF alpha |
| IFN beta |
| IFN lambda 1/IL-29 |
ギャップジャンクションタンパク質
ターゲット |
| Claudin 2 |
| Claudin 7 |
| Occludin |
| ZO-1 |
腸管細胞マーカー
ターゲット |
| Angiopoietin 1 |
| CCL25 |
| B0AT1/SLC6A19 |


