がん細胞と免疫系研究
がん細胞と免疫細胞間の相互作用は重要な研究課題であり、研究成果を応用した治療アプローチも拡大を続けています。
免疫系ががん研究に重要な理由とは?
Hanahan博士とWeinberg博士が定義したように、免疫回避と慢性炎症は共にがんの顕著な特徴です。固形がんは、がん細胞および細胞外マトリックス(ECM:Extracellular matrix)、免疫細胞や内皮細胞等の付帯的な細胞で構成されます。がん細胞はがん微小環境内の免疫細胞を調節し、免疫細胞による攻撃を回避するだけではなく腫瘍の増殖を促進します。この現象は、腫瘍関連マクロファージ(TAM:Tumor-Associated Macrophage)や腫瘍関連好中球(TAN:Tumor-Associated Neutrophil)、活性が制御されたT細胞等によって媒介されます。
炎症性免疫細胞の動員は腫瘍関連性の慢性炎症を引き起こし、さらなるゲノム不安定性、エピジェネティック修飾、抗アポトーシス経路に寄与し、腫瘍増悪の悪循環を発生させる可能性があります。
播種性腫瘍細胞(DTC:Disseminated tumor cell)は、血液やリンパ系を介して移動する際にも免疫細胞による攻撃を回避する分子機構を有していると考えられています。転移の際、遠位の臓器で腫瘍細胞がコロニーを形成すると、自身の生存と定着のためにその臓器の免疫微小環境を調節します。
がん治療としての免疫療法
がん細胞とその免疫微小環境の重要性の特性解析が一段と進むにつれて、免疫療法は飛躍的に発展しています。免疫療法は、外科手術、化学療法、放射線療法等のがんの標準治療に対して、より限定した標的に対するアプローチを提供します。標準治療は様々な副作用を伴い、すべての種類のがんが奏効するわけではありません。特に、特定の種類の希少がんは症例が少なく、外科的切除が不可能であったり化学療法や放射線療法に抵抗性(耐性)を示すことがあるため、代替の治療計画の策定が求められます。代替治療の中には次のようなものがあります。
- モノクローナル抗体—がん特異的抗原をターゲットとする組換え抗体で、がんの増殖を抑制したり、どのがん細胞を死滅させるのかを免疫系に対してシグナル伝達します。このタイプの抗がん剤は、特徴的なマーカーが判明しているがんの治療に特に有用です。例えば、ハーセプチン®(Herceptin®、一般名:トラスツズマブ)は、抗HER2ヒト化モノクローナル抗体を有効成分とする抗悪性腫瘍剤です。HER2過剰発現が確認された転移性乳癌に対する有効性が認められ医薬品として承認されました。アバスチン®(Avastin®、一般名:ベバシズマブ)は、血管新生を抑制する働きを示す抗VEGFヒト化モノクローナル抗体を有効成分とする抗悪性腫瘍剤で、化学療法と併用することで、結腸・直腸癌の増殖を阻害する血管新生阻害剤として用いられています。
- CAR-T療法—新規の免疫療法であるCAR-T療法(キメラ抗原受容体T細胞療法)は、外科手術や放射線療法等の標準治療による治療が効果を示さない白血病やリンパ腫等の全身性のがん患者において非常に良好な臨床成績を得ている細胞療法です。CAR-T療法では、T細胞が有する細胞傷害性を利用し、がん細胞を標的とするよう加工したT細胞を治療に使用します。はじめに患者のT細胞を単離し、キメラ抗原受容体(CAR:Chimeric Antigen Receptor)をコードする遺伝子を導入します。その後、CAR発現T細胞(CAR-T細胞)をex vivoで培養増殖して患者に点滴投与すると、CAR-T細胞ががん細胞に対して効果を示します。
関連製品:プロテインテックのcGMPグレードサイトカイン&増殖因子 - 免役チェックポイント阻害剤—免役チェックポイント阻害剤は、免疫細胞やがん細胞に発現する免疫応答抑制性受容体をターゲットにし、腫瘍に対する免疫応答を促進する医薬品です。
プロテインテックの注目製品:PD-1/PD-L1パスウェイ - がんワクチン—標準的なワクチンと同様に、がん特異的抗原を患者に導入し、がんに対する免疫応答を刺激します。
がん研究における免疫系の研究手法
-
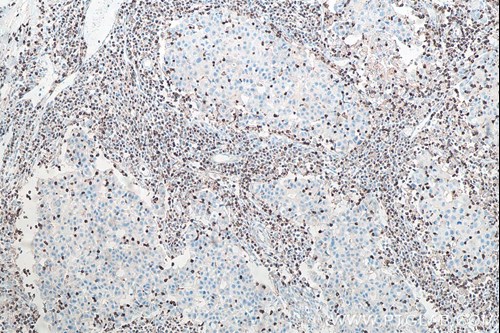
原発腫瘍—原発腫瘍における免疫細胞の浸潤は、がんや腫瘍に存在する免疫細胞の種類に応じて腫瘍の増殖を促進または阻害します。免疫組織化学(IHC:Immunohistochemistry)は免疫細胞の浸潤の程度を評価する方法の1つです。プロテインテックはCD3、Cb11b、F4/80等をターゲットとする「IHCeasy」キットを販売しています。IHCeasyキットを使用すれば、T細胞、好中球、マクロファージ等の腫瘍内における特定の免疫細胞の局在を容易に同定することが可能です。また定量的な測定手法であるフローサイトメトリー(FC:Flow cytometry)も、原発腫瘍における免疫細胞の浸潤を評価するために使用することができます。
 |
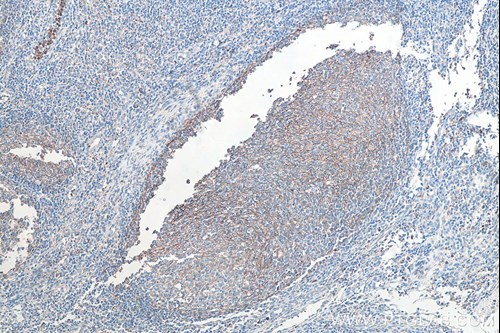 |
| 図1-1. IHCeasy CD3 Ready-to-use IHC kit(カタログ番号:KHC0013)を使用したパラフィン包埋ヒト乳がん組織スライドの免疫組織化学染色。CD3:T細胞マーカー。 | 図1-2. IHCeasy CD11B Ready-to-use IHC kit(カタログ番号:KHC0027)を使用したパラフィン包埋ヒト扁桃炎組織スライドの免疫組織化学染色。CD11b:マクロファージマーカー。 |
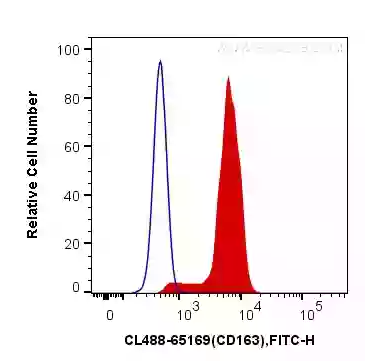
図2. ヒト末梢血単核細胞(PBMC:Peripheral blood mononuclear cell)のフローサイトメトリー:1x10^6個のPBMC細胞の細胞膜表面をCoraLite® Plus 488標識ヒトCD163抗体(カタログ番号:CL488-65169、5μl、赤)、またはCoraLite® Plus 488標識マウスIgG1アイソタイプコントロール抗体(カタログ番号:CL488-66360、クローン番号:1F8D3、青)を使用して染色した。CD163:腫瘍関連マクロファージ(TAM:Tumor-associated macrophage)マーカー。細胞:固定処理なし。
-
全身性がん—血液サンプリングをすることで、全身性がんの様々なステージにおける循環器系の免疫細胞を解析することができます。フローサイトメトリーによって、がんの様々な進行ステージにおける血液系の免疫プロファイルを把握できるデータが得られます。
-
転移部位—フローサイトメトリー、免疫組織化学、免疫蛍光染色(IF:Immunofluorescence)、ウェスタンブロット(WB:Western blot)等を用いることで、がんの様々なステージにおける臓器の免疫プロファイルを調査することができます(例:転移の有無)。播種性腫瘍細胞は、転移臓器の免疫環境を生存に適した環境に調節する等、原発部位から離れた定着先の臓器と相互作用してその臓器を調節します。播種性腫瘍細胞が転移した臓器の変化を解明することで、転移部位における腫瘍細胞の生存と定着の防止に貢献できる可能性があります。
表1:プロテインテックの免疫マーカー関連製品
|
|
プロテインテックのフローサイトメトリー用標識抗体のページでは、多重染色パネルの構築が可能な蛍光スペクトルビューアーをご利用できる他、販売中の様々な蛍光色素をご覧いただけます。
Lucie Reboud著(マンチェスター大学博士課程4年、プロテインテックScience Marketingインターン生)
参考文献
D Hanahan, R A Weinberg. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4;144(5):646-74.
K J Hiam-Galvez, et al. Systemic immunity in cancer. Nat Rev Cancer. 2021 Jun;21(6):345-359.



