がん幹細胞:がん治療研究の鍵となる標的細胞
がん幹細胞(CSC:cancer stem cell)とがん幹細胞マーカーについて解説します。
近年の免疫療法やCAR-T細胞療法の発展によって、がん治療は急速に進歩し、寛解率も上昇傾向にあります。しかしながら、がんに対する「特効薬」は未だに存在しません。特効薬が存在しない理由の1つに、現在のがん治療では、不適切な細胞を標的にしている可能性があることが挙げられます。近年、腫瘍内における「がん幹細胞(CSC:cancer stem cell)」と呼ばれるサブ集団の存在についての仮設が提唱され、広く認知されています。がん幹細胞は、がん細胞ではあるものの、自己複製能と腫瘍内に生じる様々な種類の細胞への分化能といった幹細胞様の特性を示します。
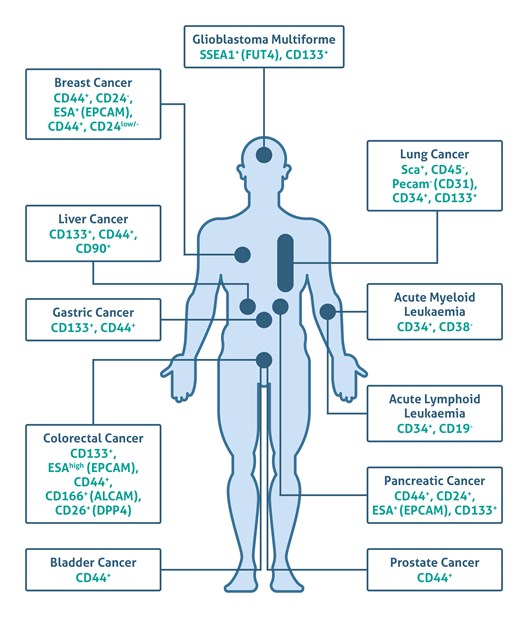
約150年前、Julius Cohnheim博士(1839-1884)は、成体組織中には発生中に使用されずに残された「胚の残り」が存在し、非自然発生的にがんに進展することを示唆する、がん幹細胞(CSC)仮説(別名:embryonal-rest theory)を初めて提唱しました(1)。その後、1994年にJohn Dick博士(1954-)らによって、重症複合免疫不全(SCID)マウスに白血病患者の血液中に存在する白血病を惹起する幹細胞(LSC:leukemia stem cell、白血病幹細胞)を移植した際に、急性骨髄性白血病(AML:acute myelogenous leukemia)を誘発する可能性があることが示されるまで(2)、がん幹細胞(CSC)仮説の実験的エビデンスはわずかにしか存在しませんでした。それから、研究の進展によって、脳、乳房、前立腺、膵臓、肝臓、卵巣、皮膚、大腸がん、メラノーマ等のヒト固形腫瘍中のがん幹細胞(CSC)の同定を可能する細胞表面上の幹細胞マーカー(例:CD133、CD44、CD24)が幅広く明らかになりました(3-6)(図1:参考文献7の図を編集しています)。
 |
|
図1. 拡大図(マーカー名をクリックすると抗体製品ページに移動できます) |
がん幹細胞(CSC)は、その幹細胞様の特性の他に、様々ながん治療に耐性を示す特徴から、薬理研究において焦点となっています。がん幹細胞(CSC)の理解を深めるためのさらなる研究が必要とされることは言うまでもありませんが、現時点でがん幹細胞(CSC)ががんの予後、進行、治療戦略において重要な役割を果たしている可能性を示すエビデンスが存在していることも事実です。そのため、患者の長期にわたる生存期間は、がん幹細胞(CSC)を排除できるかに依存している可能性があるという仮説に基づいて研究が進められています。
前述の細胞マーカーを使用して純粋ながん幹細胞(CSC)集団を単離できるようになったことで、がん幹細胞(CSC)表現型の不均一性や可塑性に対する理解が深まっています。がん幹細胞(CSC)集団を同定するためのマーカーには、CD44(カタログ番号:15675-1-AP)、CD24(カタログ番号:18330-1-AP)、CD133(カタログ番号:18470-1-AP)、LC3B(カタログ番号:18725-1-AP)等があります。
 |
|
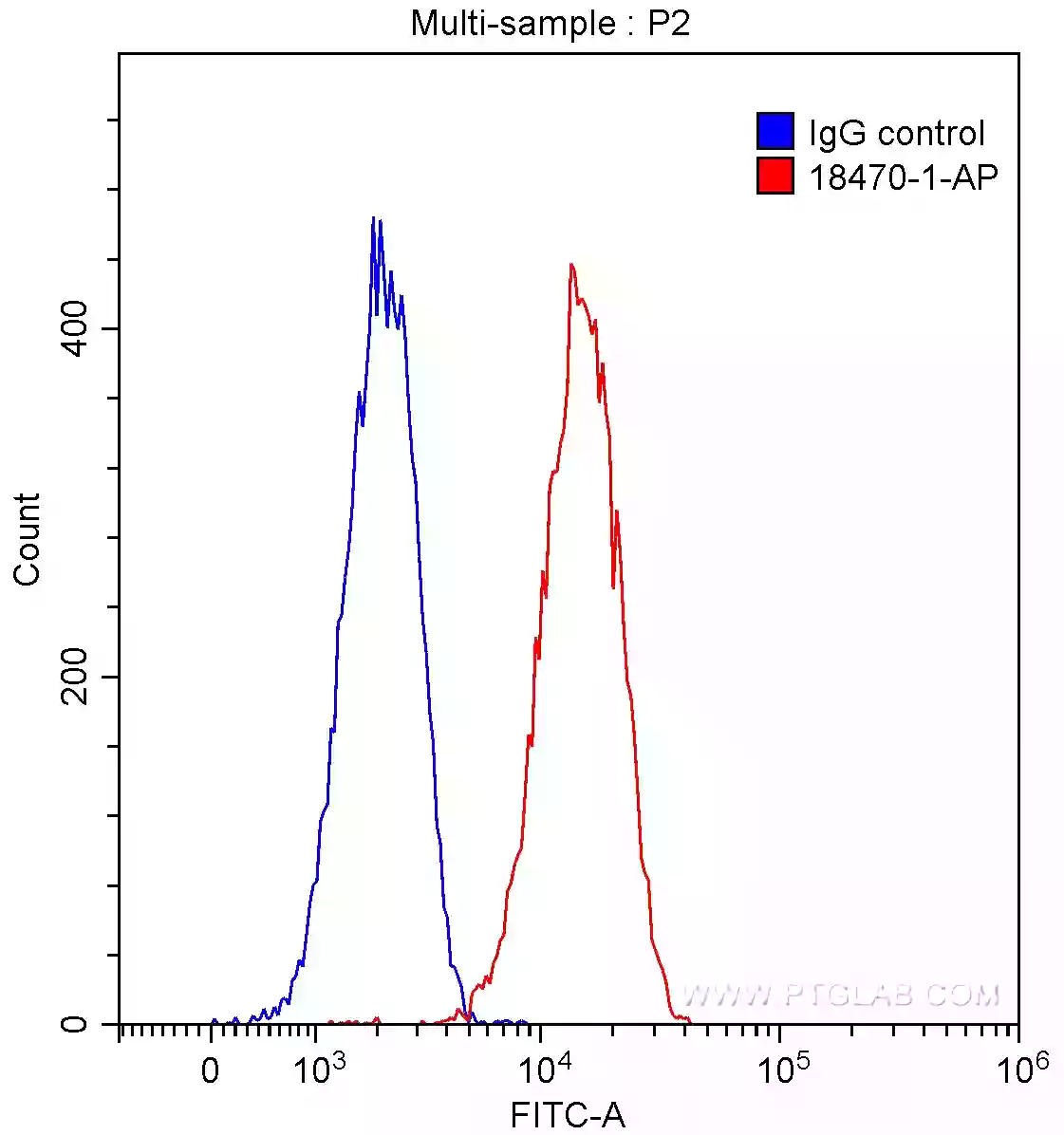
図2. HT-29細胞のフローサイトメトリー解析。赤:CD133抗体(カタログ番号:18470-1-AP)。青:ウサギIgGコントロール抗体。使用細胞:90% MeOH固定HT-29細胞(1X10^6 cells)。蛍光検出:Alexa Fluor 488標識AffiniPure Goat Anti-Rabbit IgG(H+L)(希釈倍率1:1000)を使用した。 |
 |
|
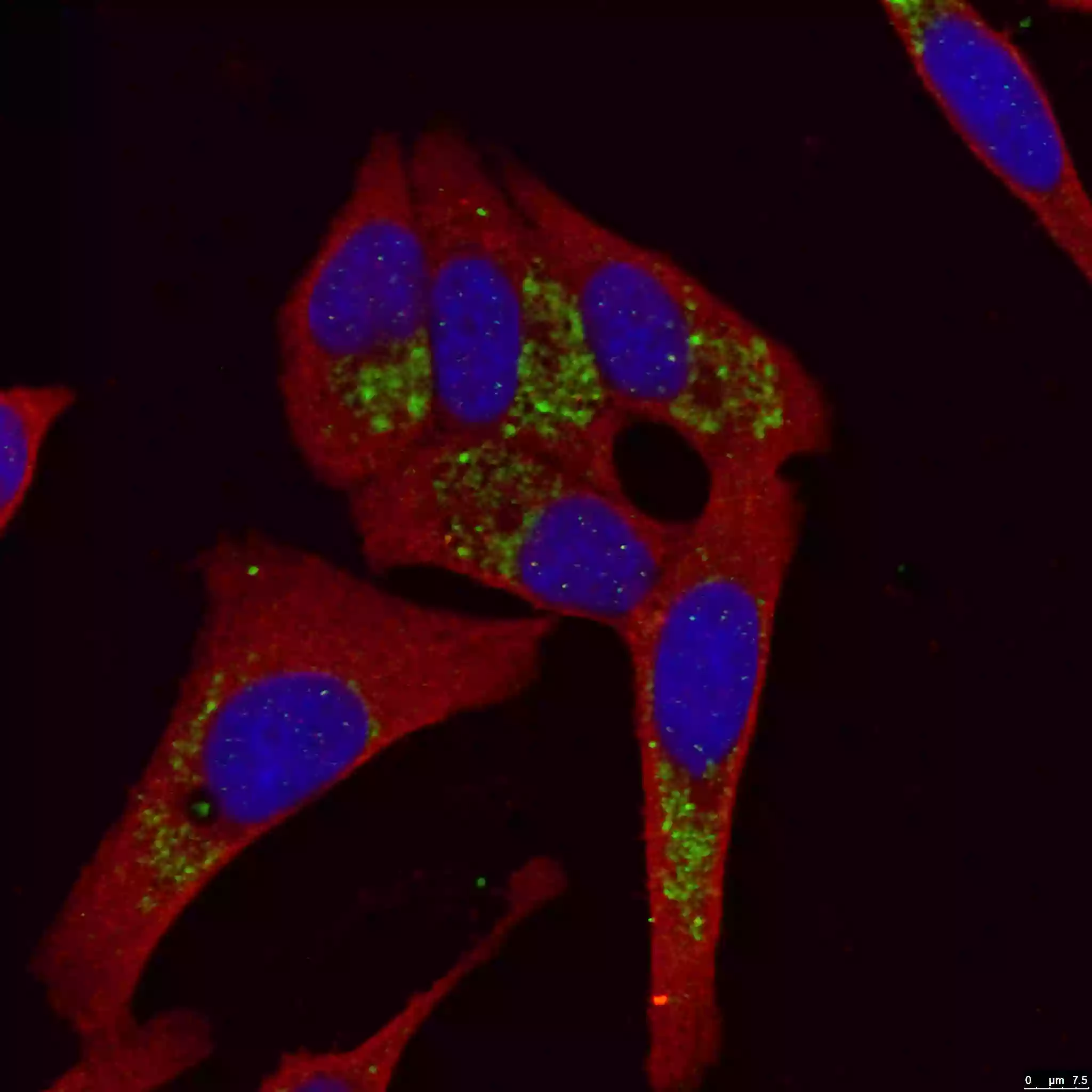
図3. LC3B-Specific抗体(カタログ番号:18725-1-AP、希釈倍率1:50)を使用したHepG2細胞の染色画像。緑:LC3B-Specific抗体。赤:Tubulin抗体(カタログ番号:66031-1-Ig、希釈倍率1:100)。細胞:4% PFA固定、0.2% Triton X-100透過処理を実施し、LC3B-Specific抗体とTubulin抗体で共染色した(40倍レンズを使用)。 |
がん幹細胞(CSC)仮説や薬理学的ターゲットとしてのがん幹細胞(CSC)の可能性を裏付けるエビデンスは積み重ねられ続けています。幹細胞は細胞傷害に対しても耐性があるため、がん幹細胞(CSC)のがん治療感受性を誘導する有望な手法の1つに、正常な幹細胞の機能や関連するシグナル伝達経路(Notch、Hedgehog、Wntシグナル伝達経路等)を遮断するという手法が挙げられています。さらに、幹細胞ニッチが幹細胞性の維持に極めて重要な役割を果たしているのと同様に、微小環境と腫瘍との間の様々なネットワークとその関係性ががん幹細胞(CSC)サブ集団の増殖に重要な役割を果たしていると考えられています。そのため、腫瘍と微小環境との関係性の破壊は、がん幹細胞(CSC)のがん治療に対する抵抗性を抑制する鍵となる可能性があります。加えて、がん幹細胞(CSC)研究は、がんが進行する過程で活性化する新規の幹細胞経路についての手掛かりを提供し、更なる治療を実施する際の指標や臨床試験計画の指針となる可能性があります。
著者:Karolina Szczesna(生物医学博士)
プロテインテック プロダクトマネージャー
参考文献
- J E Visvader. Cells of origin in cancer. Nature. 2011 Jan 20;469(7330):314-22.
- T Lapidot, et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 1994 Feb 17;367(6464):645-8.
- T Schatton, et al. Identification and targeting of cancer stem cells. Bioessays. 2009 Oct;31(10):1038-49.
- S K Singh. Identification of human brain tumour initiating cells. Nature. 2004 Nov 18;432(7015):396-401.
- V Tirino. The role of CD133 in the identification and characterisation of tumour-initiating cells in non-small-cell lung cancer. Eur J Cardiothorac Surg. 2009 Sep;36(3):446-53.
- Y-C Wang, et al. ALDH1-bright epithelial ovarian cancer cells are associated with CD44 expression, drug resistance, and poor clinical outcome. Am J Pathol. 2012 Mar;180(3):1159-1169.
- S S Franco, K Szczesna, et al. In vitro models of cancer stem cells and clinical applications. BMC Cancer. 2016 Sep 30;16(Suppl 2):738.


