特集:脳腫瘍マーカー
脳腫瘍は、頭蓋骨の内側にできる腫瘍の総称であり、130種類以上に細分類されます。任意の細胞の異常増殖が、脳組織内の腫瘍増大の原因となります。
脳腫瘍は、その種類によって腫瘍の位置や増殖速度が異なり、一般的には腫瘍の由来する細胞の種類(発生母地)に従って分類されます(1,2)。また、成人の脳腫瘍と小児の脳腫瘍には明確な違いがあります。
癌遺伝子
腫瘍抑制因子であるp53やPTENは、多くの種類の癌と関連しており、その変異は様々な種類の脳腫瘍に認められます(3)。癌遺伝子としても知られる癌抑制因子の変異は、細胞周期移行、増殖、およびアポトーシス等の下流で生じる反応に影響を及ぼし、腫瘍細胞の異常増殖に関係します。
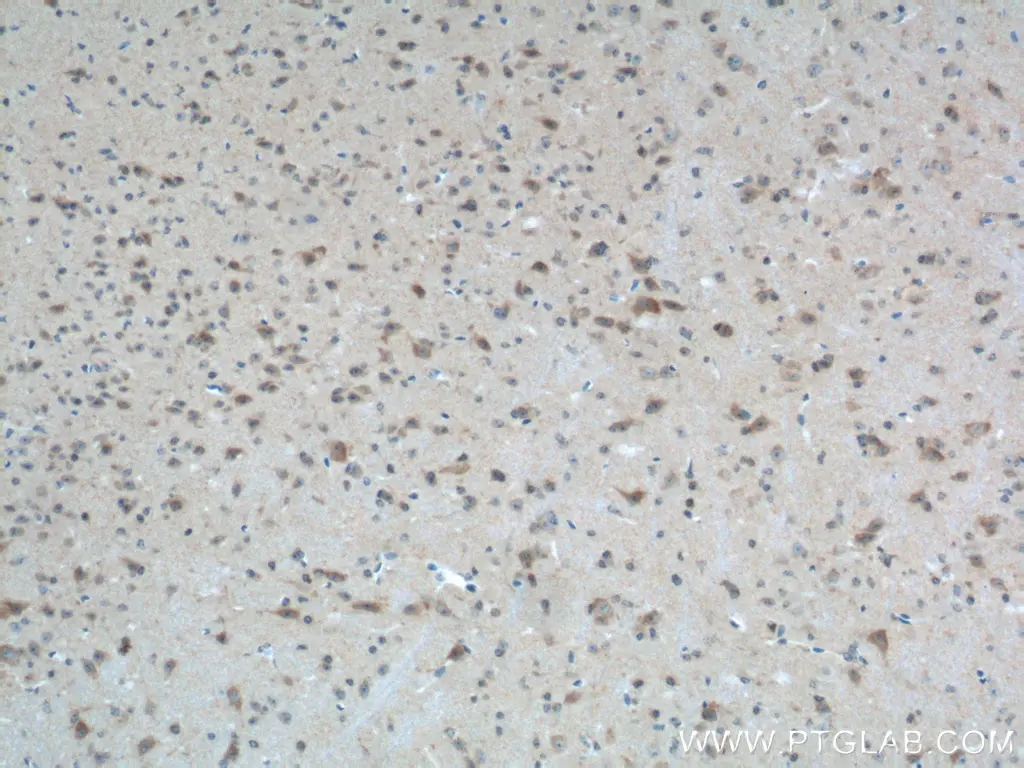 |
|
図1. PTEN抗体(カタログ番号:22034-1-AP、希釈倍率:1:200)を使用したパラフィン包埋ヒト前立腺癌組織スライドの免疫組織化学(IHC:Immunohistochemistry)染色(40倍レンズを使用)。 |
上方制御/発現上昇(アップレギュレーション)
組織マーカーの多くは、正常な細胞と同様に腫瘍細胞でも発現する一方、その発現レベルが異なるため、遺伝子発現パターンの差がマーカーとしてしばしば使用されます。PDGFRaやEGFR等の増殖因子受容体の過剰発現や発現レベルの変化は、正常な脳組織よりも腫瘍組織/腫瘍細胞を示している可能性があり、腫瘍の増悪やクローン性増殖に関連することが報告されています(4, 5)。神経細胞接着分子であるL1CAMの発現上昇は、脳腫瘍および神経系以外の多くの種類の癌で確認されており、L1CAMタンパク質が細胞遊走以外に腫瘍形成において役割を果たすことが示唆されています(6)。
脳腫瘍の種類
脳腫瘍は、病理組織検査等の一連の手法によって様々な種類に分類されます。グリア細胞に由来する腫瘍は神経膠腫(しんけいこうしゅ、グリオーマ、glioma)と呼ばれ、神経膠腫(glioma)はさらに由来する細胞の種類によって、星細胞腫(astrocytoma)、乏突起膠腫(oligodendroglioma)、上衣腫(ependymoma)に分類することができます。神経膠腫の様々なサブタイプは、細胞特異的マーカーによって同定することができます。例えば、星細胞腫(astrocytoma)はGFAPを発現しています。複数の異なる種類の細胞で構成される不均一性腫瘍もこの方法で同定できます。WHO Classification of Tumors of the Central Nervous Systemによる腫瘍分類(WHO腫瘍分類)は、腫瘍の種類の診断に最も一般的に使用されている方法です。
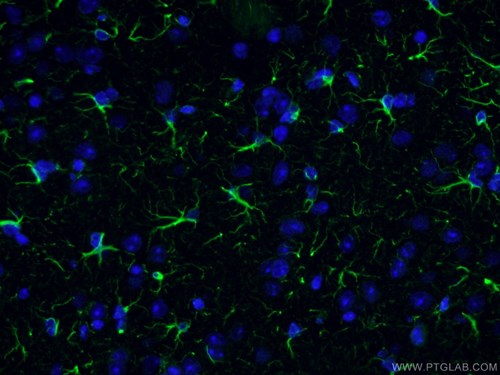 |
|
図2. GFAP抗体(カタログ番号:16825-1-AP、希釈倍率:1:200)、Alexa Fluor 488標識AffiniPureヤギ抗ウサギIgG(H+L)を使用したマウス脳組織(4% PFA固定)の免疫蛍光染色(IF:Immunofluorescence)。 |
成人脳腫瘍のうち最も一般的な種類は、膠芽腫(GBM:glioblastoma、グリオブラストーマ)です。膠芽腫(GBM)は、分化した星細胞(アストロサイト)系細胞や神経幹細胞様細胞等の様々な種類の細胞を含む、進行度グレード4に分類される星細胞腫(astrocytoma)です。膠芽腫(GBM)の全エクソームシーケンシングにより、腫瘍のサブタイプを特徴付ける一般的な変異が明らかにされました(7)。全エクソームシーケンシング等の遺伝子解析によって、膠芽腫(GBM)を様々な遺伝子の変異の違いによって特徴付けされた4種類の分子サブタイプ(proneural、neural、classical、mesenchymal)に分類することが可能になりました。
膠芽腫(GBM)の遺伝子変異の一例として、代謝酵素IDHの変異が挙げられます。IDHの遺伝子変異は当該タンパク質の機能を変化させる変異であり、患者の予後に影響すると考えられ(8)、治療のターゲット候補として研究されています。
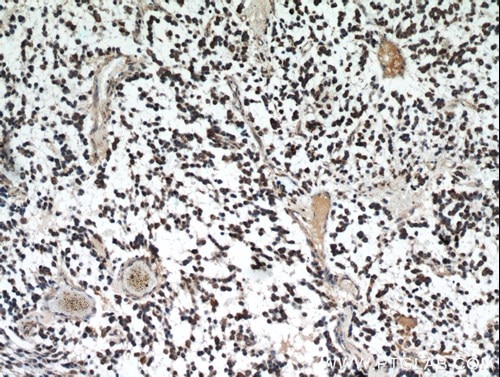 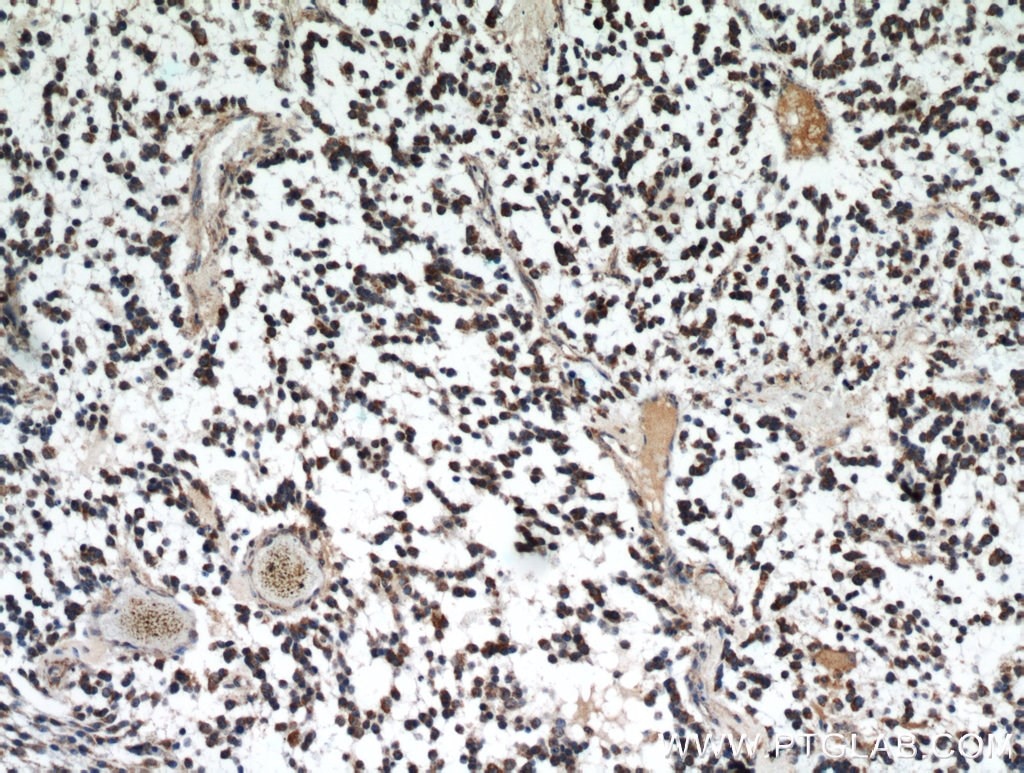 |
|
図3. IDH1抗体(カタログ番号:12332-1-AP、希釈倍率:1:50)を使用したパラフィン包埋ヒト神経膠腫の免疫組織化学染色(10倍レンズを使用)。 |
グリア細胞以外の細胞に由来する脳腫瘍は、膠芽腫(GBM)等と比較すると一般的ではありませんが、髄膜腫瘍(meningeal tumors)、リンパ腫(lymphomas)、脳神経・傍脊髄神経(tumors of the cranial and paraspinal nerves)等の腫瘍があります。神経膠腫と同様に、これらの腫瘍も細胞特異的マーカーを発現しています。例えば、神経芽細胞腫(neuroblastoma)組織は、シナプトフィジン(Synaptophysin)を発現しています。
癌幹細胞
脳腫瘍の細胞不均一性は、腫瘍内に存在する癌幹細胞によって付与され、癌幹細胞は患者の生検によって同定されます。多能性と自己複製能を備える癌幹細胞は、多くの腫瘍が化学療法に対して耐性を有し、治療後に再発する原因であると考えられています。脳腫瘍内の癌幹細胞は、ネスチン(Nestin)やOlig2等の一般的な神経幹細胞のマーカー発現によって同定されます。ネスチン(Nestin)とOlig2は、それぞれ神経細胞系とグリア細胞系のマーカーであり、完全に分化した成熟細胞には認められません。また、FOXG1やSox2等の神経発生に関与する転写因子は、脳腫瘍の癌幹細胞で発現の上昇が認められており、増殖表現型に関与することが示されています(9)。
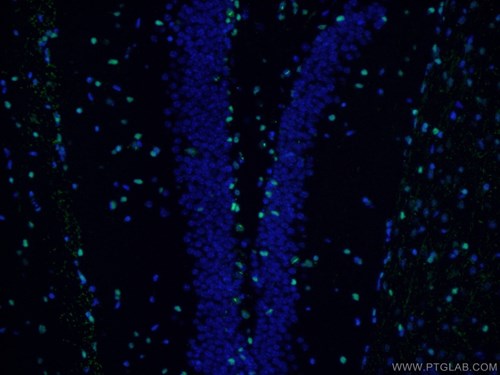 |
|
図4. SOX2抗体(カタログ番号:11064-1-AP、希釈倍率:1:50)、Alexa Fluor 488標識AffiniPureヤギ抗ウサギIgG(H+L)を使用したマウス脳組織(4% PFA固定)の免疫蛍光染色。 |
膨大な種類の脳腫瘍が存在するため、in vivoやin vitroにおいてメカニズムの同定や研究の遂行には、様々な種類のマーカーが必要とされます。
脳腫瘍マーカー関連製品
|
マーカー名 |
機能 |
カタログ番号 |
|
癌抑制遺伝子 |
10442-1-AP 他多数 |
|
|
細胞周期調節、腫瘍抑制 |
22034-1-AP 他多数 |
|
|
細胞表面増殖因子受容体 |
60045-1-Ig |
|
|
細胞表面増殖因子受容体 |
18986-1-AP 他多数 |
|
|
膜貫通型神経細胞接着分子 |
20659-1-AP 他多数 |
|
| アストロサイトマーカー、中間径フィラメントタンパク質 |
16825-1-AP 他多数 |
|
|
乏突起膠細胞(オリゴデンドロサイト)系マーカー |
13999-1-AP 他多数 |
|
|
細胞質内NADPH産生酵素 |
12332-1-AP 他多数 |
|
| Synaptophysin |
神経細胞マーカー、シナプス小胞タンパク質 |
17785-1-AP 他多数 |
| Nestin |
CNS幹細胞マーカー、中間径フィラメントタンパク質 |
19483-1-AP 他多数 |
|
脳の発生に関与する転写因子 |
12764-1-AP |
|
|
神経幹細胞の維持に関与する転写因子 |
11064-1-AP 他多数 |
参考文献
- D N Louis, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol. 2007 Aug;114(2):97-109.
- D N Louis, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 2016 Jun;131(6):803-20.
- F Checler, C A da Costa. p53 in neurodegenerative diseases and brain cancers. Pharmacol Ther. 2014 Apr;142(1):99-113.
- C Gialeli, N K Karamanos, et al. PDGF/PDGFR signaling and targeting in cancer growth and progression: Focus on tumor microenvironment and cancer-associated fibroblasts. Curr Pharm Des. 2014;20(17):2843-8.
- F Lu, Q R Lu, et al. Olig2-Dependent Reciprocal Shift in PDGF and EGF Receptor Signaling Regulates Tumor Phenotype and Mitotic Growth in Malignant Glioma. Cancer Cell. 2016 May 9;29(5):669-683.
- P Altevogt, K Doberstein, M Fogel. L1CAM in human cancer. Int J Cancer. 2016 Apr 1;138(7):1565-76.
- D W Parsons, et al. An integrated genomic analysis of human glioblastoma multiforme. Science. 2008 Sep 26;321(5897):1807-12.
- A L Cohen, S L Holmen, H Colman. IDH1 and IDH2 mutations in gliomas. Curr Neurol Neurosci Rep. 2013 May;13(5):345.
- H Bulstrode, S M Pollard, et al. Elevated FOXG1 and SOX2 in glioblastoma enforces neural stem cell identity through transcriptional control of cell cycle and epigenetic regulators. Genes Dev. 2017 Apr 15;31(8):757-773.




