非アポトーシス性細胞死
はじめに
アポトーシス(apoptosis)は、最も早期に発見され、最も幅広く研究されている細胞死の経路です。しかし、近年、複数の「非アポトーシス性細胞死(Non-Apoptotic Cell Death)」の経路が様々な疾病の病態形成に関与していることが報告されており、がん治療に応用できる可能性も示唆されることから、大きな注目を集めています。非アポトーシス性細胞死では、クロマチン凝縮、核の断片化、細胞膜のブレブ形成(blebbing:ブレビング、水疱形成、水疱状突起形成)等の典型的なアポトーシスの形態が認められず、アポトーシス性カスパーゼが介在しないことを特徴とします。それらの細胞死経路は、すべて非アポトーシス性細胞死に分類され、特に広く研究されている非アポトーシス性細胞死経路として、フェロトーシス(ferroptosis)、パイロトーシス(pyroptosis)、ネクロプトーシス(necroptosis)が挙げられます。
プロテインテックは、非アポトーシス性細胞死の研究に有用な様々な製品を取り揃えています。
目次 |
フェロトーシス(Ferroptosis)
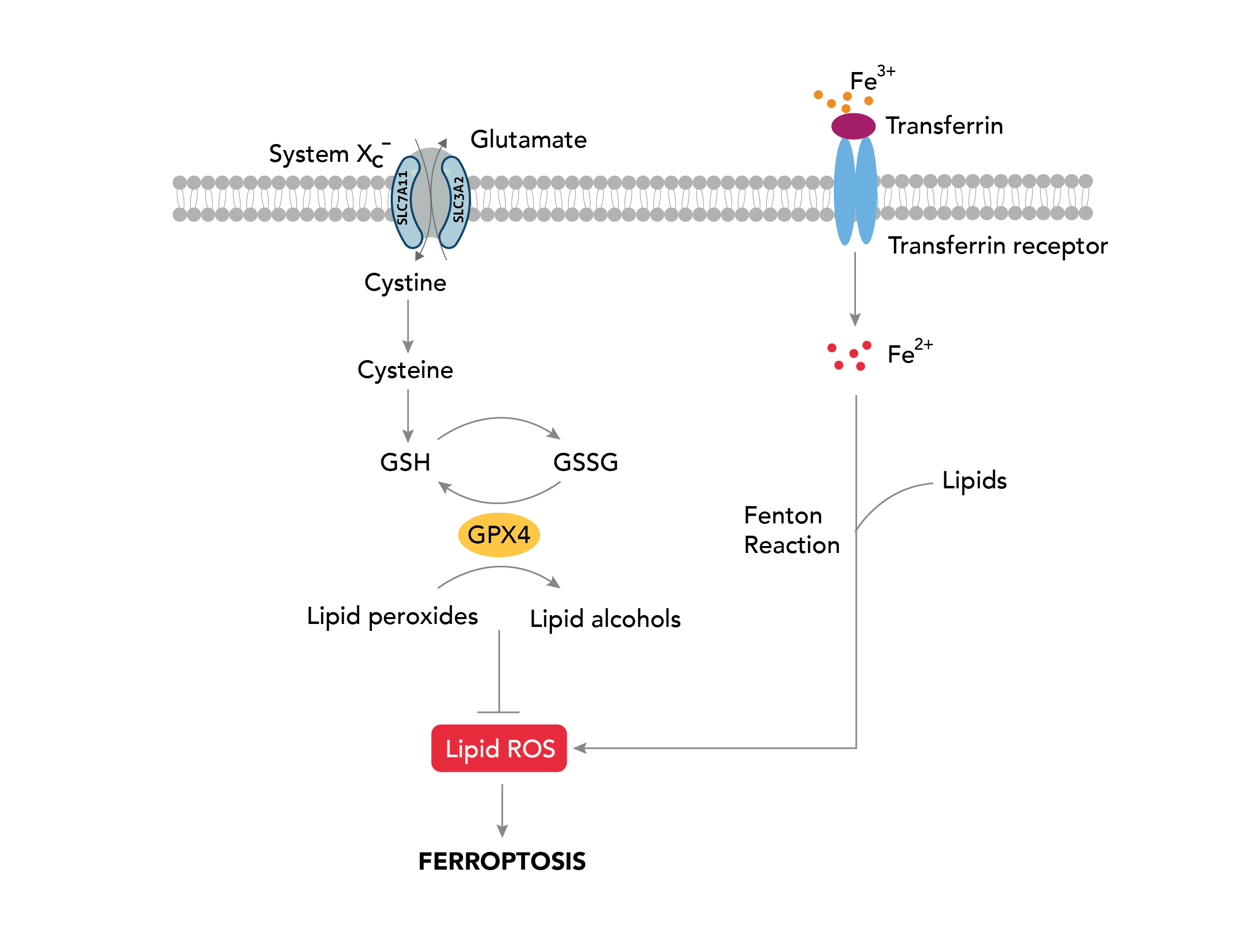
フェロトーシスは、細胞内の活性酸素種(ROS:reactive oxygen species)レベルの増加を特徴とする、鉄依存の制御された細胞死です。フェロトーシスの主な形態的特徴は、ミトコンドリアのクリステの減少や消失を伴うミトコンドリア体積の減少で、この現象は他の細胞死経路では通常認められません。
GPX4(Glutathione peroxidase 4、グルタチオンペルオキシダーゼ4)は、グルタチオン依存的に活性を示す抗酸化酵素であり、フェロトーシス経路の重要な制御因子として機能します。GPX4は、還元型グルタチオン(GSH:Glutathione-SH)を補因子として利用し、細胞内の過酸化脂質(lipid peroxide)を還元します。細胞内の還元型グルタチオン(GSH)の枯渇が原因となり、GPX4が不活性な状態になると、活性酸素種(ROS)の蓄積が生じ、フェロトーシスが誘発されます。フェロトーシスは他にも、アミノ酸トランスポーターであるSLC7A11(xCT)とSLC3A2(CD98)で構成される、グルタミン酸代謝経路に関連するSystem xc-(シスチン/グルタミン酸交換輸送体、xc-系)による調節を受けます。System xc-が阻害されると、細胞内へ取り込まれるシスチン/システインが減少することによって還元型グルタチオン(GSH)の生合成が妨げられます。その結果、GPX4活性の還元作用が機能不全に陥り、酸化ストレスが亢進することで、フェロトーシスが誘発されます。
トランスフェリン受容体は、細胞内への鉄イオンの取り込みを調節する受容体タンパク質であり、フェロトーシスに極めて重要な役割を果たします。細胞内に取り組まれた過剰な鉄イオンは、フェントン反応(Fe2++H2O2→Fe3++OH-+・OH)を介したヒドロキシルラジカル(・OH)の生成に寄与し、それに伴う脂質の過酸化によってフェロトーシス性の細胞死を誘導します。また2010年代に入ってからは、GPX4非依存性のESCRT-III依存性細胞膜修復経路やFSP1-CoQ10経路等のいくつかの経路がフェロトーシスの調節に関与することが報告されています。
関連製品
| GPX4 | CHAC1 | SLC7A11/xCT |
| FSP1 | CBS | NOX1 |
| KEAP1 | COX2 | Transferrin receptor |
| NRF2 | DMT1 | HO-1 |
| CD98/SLC3A2 | GSS | Ferritin light chain |
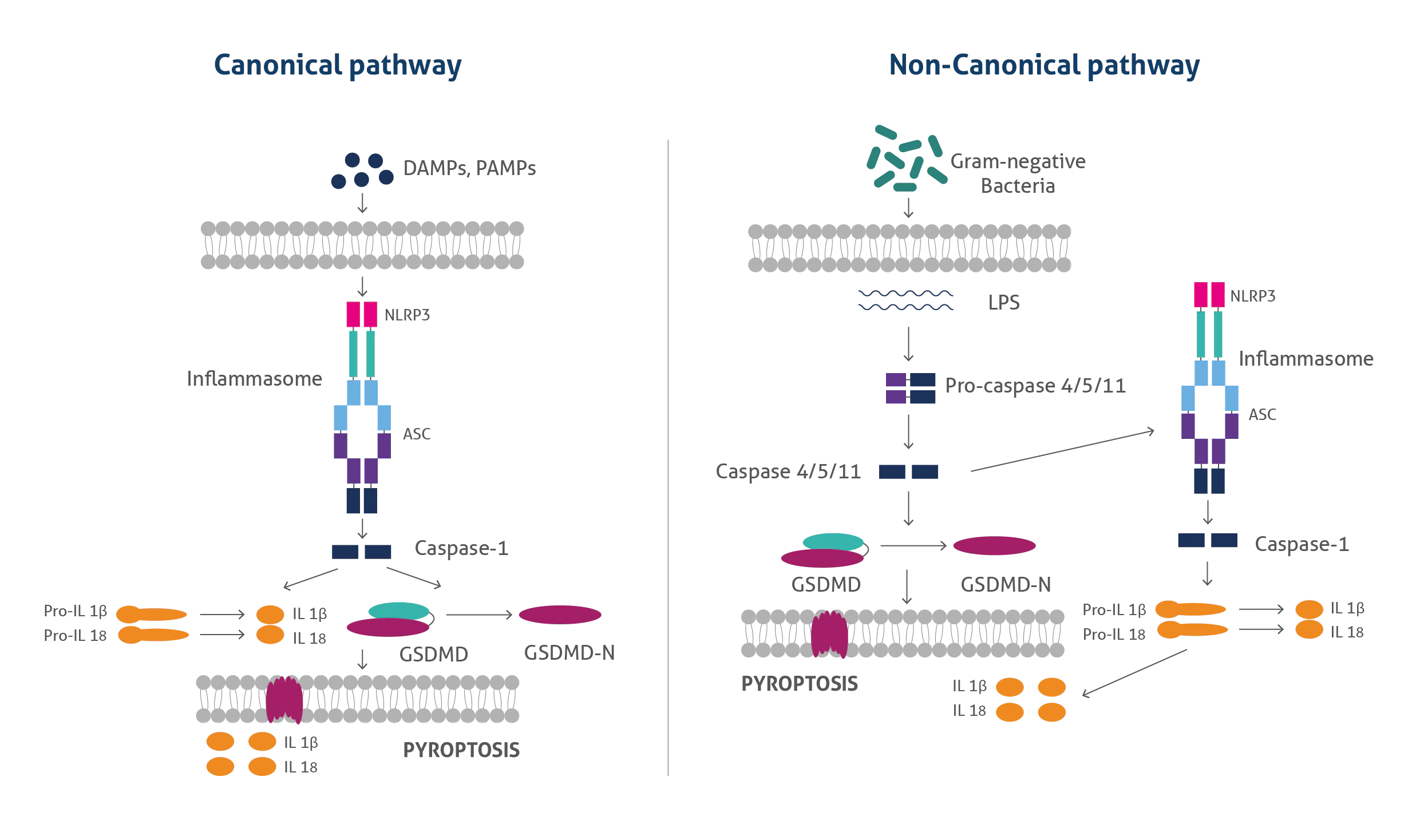
パイロトーシス(Pyroptosis)
パイロトーシスは、炎症反応を特徴とする制御された細胞死の形態です。パイロトーシスは、様々な疾病と関連があり、がん治療に効果を示す可能性のあるメカニズムであることから近年大きな注目を集めています。通常、パイロトーシスは、カノニカル(古典的)経路(canonical pathway)またはノンカノニカル(非古典的)経路(non-canonical pathway)のいずれかによって進行します。古典的経路では、細胞内のパターン認識受容体(PRR:pattern recognition receptor)が病原性刺激を認識すると応答を開始してインフラマソーム(inflammasome:炎症反応を惹起するタンパク質複合体)が組み立てられます。その結果カスパーゼ1が活性化されることによってガースダミンD(GSDMD:gasdermin D)が切断され、細孔(ポア、溶解孔)を形成し、IL-1βやIL-18等の炎症性サイトカインの放出が起こります。
パイロトーシスの非古典的経路では、グラム陰性菌由来のリポ多糖類(LPS:Lipopolysaccharides)によって、活性化されたカスパーゼ11(マウス)またはカスパーゼ4、5(ヒト)がGSDMDを切断してパイロトーシス性の細胞死を引き起こします。その後、二次的にNLRP3インフラマソームが活性化され、IL-1βやIL-18が放出されます。
関連製品
| ASC | GSDMB | IL-1 Beta |
| Caspase-1 | GSDMD | IL-18 |
| Caspase-4 | GSDME | NLRP3 |
ネクロプトーシス(Necroptosis)
ネクロプトーシス(ネクロトーシス、Necroptosis)は、TNF受容体スーパーファミリー、パターン認識受容体(PRR)、T細胞受容体、環境負荷、化学療法用薬剤等の様々な因子によって開始する「制御されたネクローシス性細胞死(regulated necrotic cell death)」経路です。ネクロプトーシスは、炎症性腸疾患、アテローム性動脈硬化症、敗血症、関節リウマチ、心虚血等の複数の炎症性疾患の病態形成に関与することが示唆されています。また、ネクロプトーシスは特定の神経変性疾患、自己免疫疾患、感染症とも関連します。
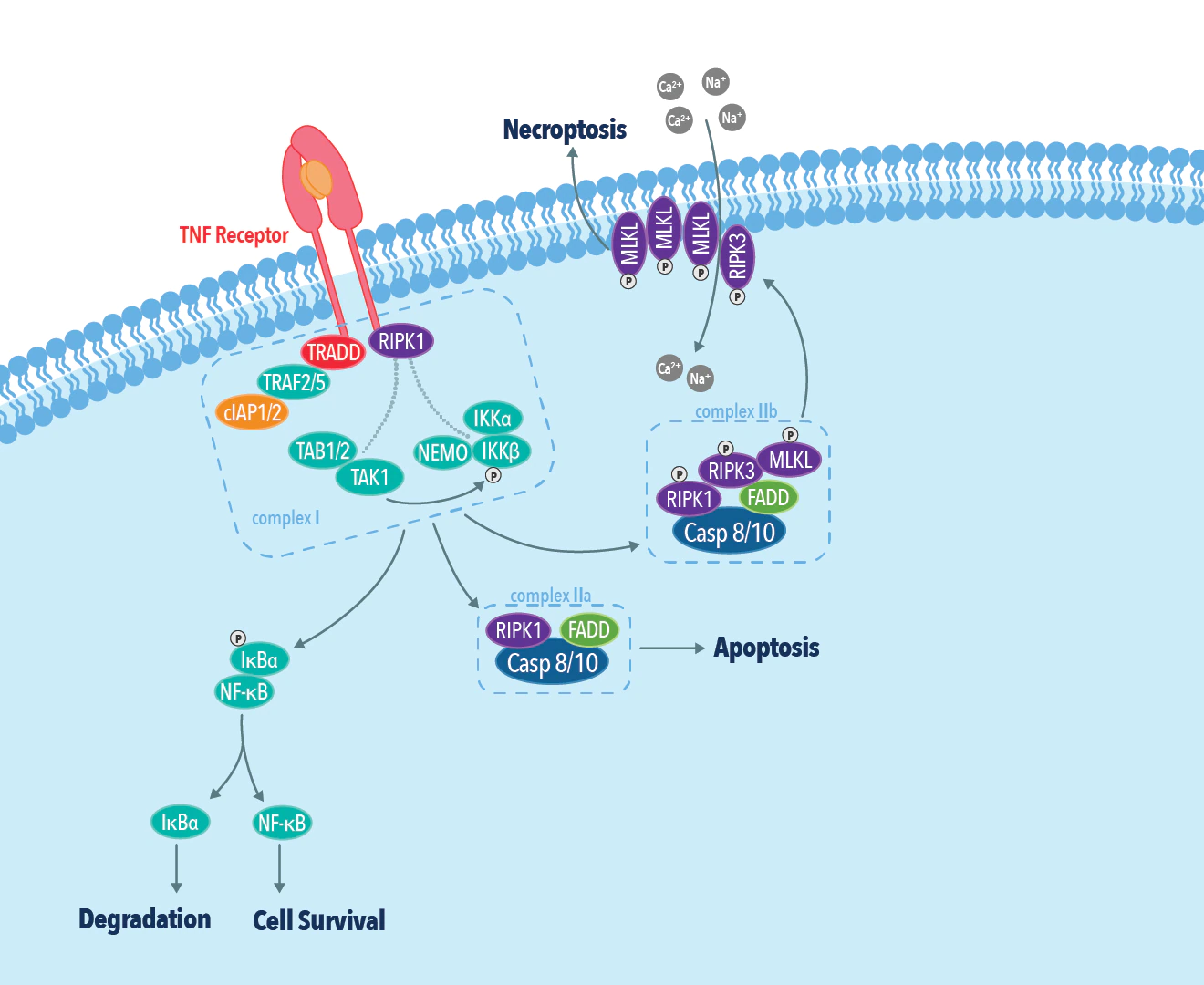
上述した因子のうち、TNFαとその受容体であるTNFR1を介したネクロプトーシスは、最もよく特性解析が行われている経路です。このTNFR1依存性ネクロプトーシス経路では、TNFR1にTNFαが結合することにより、TRADD、TRAF2/5、cIAP、RIPK1(RIP1)で構成される多量体からなるタンパク質複合体(Complex I)が組み立てられます。RIPK1は、細胞を細胞生存経路か細胞死経路のいずれかに誘導することにより、細胞運命の決定に極めて重要な役割を果たします。cIAP1/2によるRIPK1のポリユビキチン化は、NF-κBを活性化して、細胞生存経路を誘導します。一方、RIPK1のユビキチン化の阻害は、外因性アポトーシス性細胞死経路またはネクロプトーシス性細胞死経路のいずれかの細胞死経路を活性化します。RIPK1とFADD、カスパーゼ8前駆体が複合体(Complex IIa)を形成すると、カスパーゼ8が活性化されてRIPK1を切断・不活性化することによって、外因性アポトーシス性細胞死経路が誘導されます。カスパーゼ8が不活性化または阻害されている場合、RIPK1は、RIPK3(RIP3)とネクロソーム(Necrosome、Complex IIb)を形成し、ネクロプトーシス性細胞死経路を誘導します。ネクロソームがMLKLをリン酸化すると、MLKLのオリゴマー(多量体)化とそれに伴う構造変化によってMLKLが細胞膜に挿入され、細胞膜透過性を亢進させます。MLKLが細胞膜に挿入されると細胞は破裂して、DAMPs(Damage-Associated Molecular Patterns、ダメージ関連分子パターン)等の炎症を引き起こす分子が細胞外に放出されます。
関連製品
| DR5 | FLIP | TRADD |
| FADD | RIPK1 | TRAF2 |
| FAS | TNFR1 | TRAIL |
| MLKL | RIPK3 | Caspase 8 |