リン酸化タンパク質をウェスタンブロット検出するためのヒントとコツ
リン酸化タンパク質を対象とするウェスタンブロット(WB)の最適化方法に関して解説します。
タンパク質のリン酸化(phosphorylation)は、重要な翻訳後修飾の1つであり、シグナル伝達の制御やアポトーシス、代謝、増殖等の多くの生理学的プロセスで非常に重要な役割を果たします。「プロテインキナーゼ(Protein kinase、タンパク質キナーゼ、リン酸基転移酵素)」は、主にセリン(Ser、S)、スレオニン(Thr、T)、チロシン(Tyr、Y)のアミノ酸側鎖とリン酸の共有結合を触媒します。この逆反応である脱リン酸化(dephosphorylation)は「プロテインホスファターゼ(Protein phosphatase、タンパク質ホスファターゼ、脱リン酸化酵素)」によって触媒される加水分解反応に基づきます(図1)。
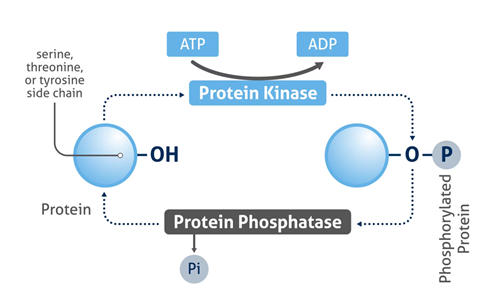
図1. タンパク質リン酸化機構の概要
ウェスタンブロット(WB:Western blot)は、タンパク質のリン酸化状態を評価するために最も一般的に使用される手法です。リン酸化タンパク質を検出するためのプロトコールは、通常のウェスタンブロットのプロトコールに対して極端な違いはありません。確実にリン酸化タンパク質を検出するためには、最適化を検討する必要のある複数の要素が存在し、その内容を以下に詳述します。
1. 目的タンパク質がいつどのようにリン酸化されるか把握する
多くのタンパク質は、例えば、特定の因子によって刺激を受けた場合や、特異的な細胞内シグナル伝達に応答する、病的状態に陥るといった、特定の条件が揃った時点においてリン酸化修飾を受けます。そのため、事前に目的タンパク質のリン酸化に関連する文献を調べ、リン酸化状態にある目的タンパク質の検出が期待される時期を推測するための参考文献を入手して、あらかじめその内容を確認してください。リン酸化が生じるために刺激が必要な場合は、様々な濃度とその他条件の検討、経時的変化を確認できる実験の検討を推奨します(例:図2、図3)。予備的実験の条件を設定し、事前検証を実施することで、タンパク質リン酸化の条件や経時的推移が判明し、目的の実験に最も適したタイムポイントを選択することができます。
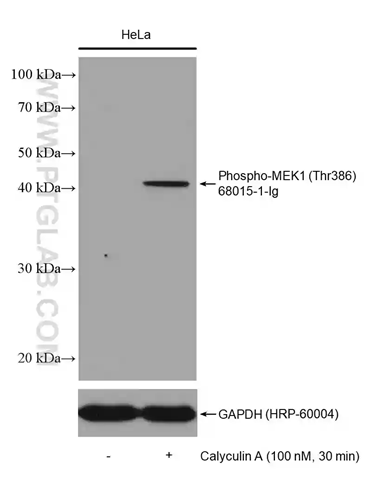
図2. Phospho-MEK1(Thr386)抗体(カタログ番号:68015-1-Ig)を使用して検出したウェスタンブロット(WB)結果(左レーン:無処理のHeLa細胞、右レーン:カルシニューリンA(Calyculin A)処理したHeLa細胞)。検出後、メンブレンをストリッピング(抗体除去)し、ローディングコントロールとしてGAPDH抗体(カタログ番号:HRP-60004)をリプローブした。
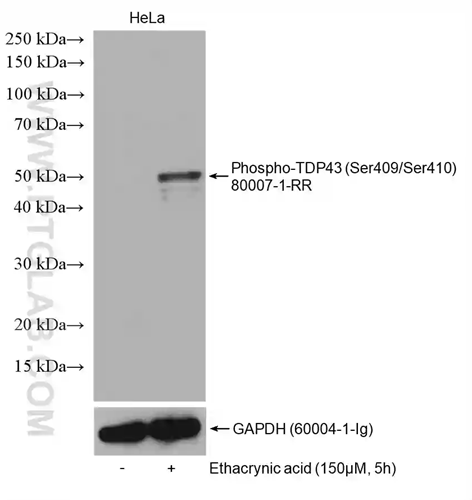
図3. Phospho-TDP43(Ser409/410)抗体(カタログ番号:80007-1-RR)を使用して検出したウェスタンブロット(WB)結果(左レーン:無処理のHeLa細胞、右レーン:エタクリン酸処理(150µM、5時間)したHeLa細胞)。検出後、メンブレンをストリッピングし(抗体除去)、ローディングコントロールとしてGAPDH抗体(カタログ番号:60004-1-Ig)をリプローブした。
2. リン酸化タンパク質をそのままの状態(インタクトな状態)に維持する
細胞等のサンプルを溶解する際に、内在性のホスファターゼ(脱リン酸化酵素)がライセート中に遊離し、急速にタンパク質の脱リン酸化が進行してしまう場合があります。このような事態を防ぐために、あらかじめ溶解バッファー(lysis buffer)にホスファターゼ阻害剤を添加しておくことを推奨します。同時にプロテアーゼ阻害剤を添加し、サンプルの分解を防ぎます。SDSサンプルバッファーのようなサンプルを還元する作用のある組成のバッファーは、ホスファターゼ活性を阻害することができます。SDSサンプルバッファーを使用する際は、ライセートを迅速にSDSサンプルバッファーへ移して保存してください。
また、サンプルは常に氷上で取り扱い、使用する試薬をあらかじめ冷却しておくことも重要です。詳細に関しては当社ブログ記事の「ライセートの調製:抽出を最適化するには?」をご覧ください。
3. ブロッキング条件を最適化する
ブロッキングはウェスタンブロット(WB)の重要なステップであり、抗体が非特異的にメンブレンに吸着するのを防ぎます。リン酸化タンパク質を検出する場合は、使用するブロッキング剤の種類に注意する必要があります。脱脂粉乳(スキムミルク、Non-fat milk)は入手しやすく安価であるため、ブロッキングに一般的に用いられています。しかし、脱脂粉乳にはカゼインが含まれています。カゼインは、リン酸化修飾を受けるリン酸化タンパク質であり、抗リン酸化抗体によって認識されてメンブレン上に検出されてしまうことで、バックグラウンドが高くなる原因になる可能性があります。したがって、一般的な5% 脱脂粉乳を使用して高いバックグラウンドが観察される場合は、使用するブロッキング剤をBSA(ウシ血清アルブミン)等の代替ブロッキング剤に変更することを検討する必要があります。
しかしながら、プロテインテックでは、リン酸化タンパク質を検出する実験を日常的に実施しており、5% 脱脂粉乳のブロッキング剤はプロテインテックのほとんどのリン酸化タンパク質抗体に利用できることを確認しています。プロテインテックの製品個別プロトコールでは、製品ごとに推奨されるブロッキング剤等の情報を参照することができます。
4. リン酸系バッファーの使用を避ける
PBS(リン酸緩衝生理食塩水)に含まれるリン酸は、抗リン酸化抗体に干渉し、抗体と標的タンパク質の相互作用に影響を及ぼす場合があります。ウェスタンブロット(WB)でリン酸化タンパク質を検出する場合は、代わりにTBST(Tween 20含有TBS)等のTris系バッファーの使用を推奨します。どうしてもPBS系のバッファーを使用しなければならないプロトコールの場合は、必ずメンブレンをTBSTで徹底的に洗浄してすべてのリン酸塩を除去してから抗体と共にインキュベーションしてください。
5. リン酸化タンパク質に特異的な抗体を使用する
リン酸化状態のタンパク質に対してのみ高い特異性を示す抗体を選択することは重要です。リン酸化タンパク質特異的でない抗体の場合、リン酸化タンパク質と非リン酸化タンパク質の両方を同時に検出することになり、結果を誤って解釈してしまう可能性があります。
プロテインテックはリン酸化タンパク質に対して高い特異性を示す抗体を多数取り揃えています。リン酸化ターゲット用の抗体はこちらから検索可能です。
6. トータルタンパク質の検出
検出されるリン酸化タンパク質のレベルは、細胞の処理方法、ゲルへのローディング時のアプライ量や実験的エラーが原因となり、変動する場合があります。そのため、ウェスタンブロット(WB)のコントロール実験として、トータルタンパク質の検出をおすすめします(例:図4)。トータルタンパク質は、実験のローディングコントロールの代わりとして参照することができ、WB検出によってトータルタンパク質に対するリン酸化タンパク質の割合を求めることができます。
メンブレンをストリッピングしてリプローブ(リプロービング)する場合、PVDF(polyvinylidene fluoride)はニトロセルロースよりも堅牢な素材であるため、PVDFメンブレンの使用を推奨します。
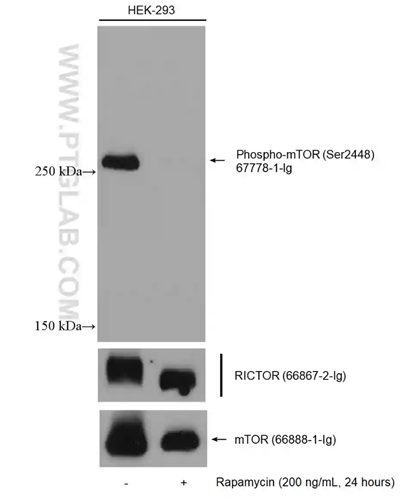
図4. Phospho-mTOR(Ser2448)抗体(カタログ番号:67778-1-Ig)を使用して検出したウェスタンブロット(WB)結果(左レーン:無処理のHEK-293細胞、右レーン:ラパマイシン処理したHEK-293細胞)。検出後、メンブレンをストリッピングし(抗体除去)、RICTOR抗体(カタログ番号:66867-2-Ig)、mTOR抗体(カタログ番号:66888-1-Ig)をリプローブした。
7. 適切なコントロールを設定する
ウェスタンブロット(WB)を実施する際は、常にコントロールも含めて実験します。例えば、リン酸化されることが判明しているタンパク質をポジティブコントロールとし、リン酸化タンパク質が存在しないサンプルをネガティブコントロールとします。
ホスファターゼ(脱リン酸化酵素)処理した細胞は、リン酸化タンパク質がホスファターゼによって脱リン酸化され、リン酸化タンパク質のバンドのシグナルの減衰または消失が観察されるはずです。そのため、リン酸化タンパク質を検出できているのかを検証する有用なコントロールサンプルとなります(図5)。ホスファターゼ処理に関する詳細はブログ記事「ウェスタンブロットに使用される酵素:適切なツールの選択」をご覧ください。
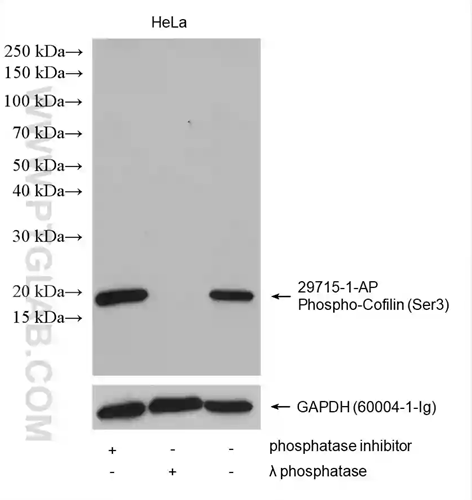
図5. Phospho-Cofilin(Ser3)抗体(カタログ番号:29715-1-AP)、GAPDH抗体(カタログ番号:60004-1-Ig)を使用して検出したウェスタンブロット(WB)結果(サンプル:HeLa細胞)。ホスファターゼ阻害剤を添加したライセートサンプル(レーン1)は、阻害剤を添加していないサンプル(レーン3)よりもリン酸化コフィリン(Phospho-Cofilin)量が増加した。λ‐ホスファターゼ処理したサンプル(レーン2)ではバンドが検出されなかった。
8. 存在量の少ないリン酸化タンパク質の検出
多くの場合、トータルタンパク質と比較すると、リン酸化タンパク質の割合は著しく微量であり、ウェスタンブロットでの検出が難しい場合があります。リン酸化タンパク質のシグナルが弱い場合、検出性を向上させるための何通りかの最適化オプションを検討してください。
- ロードするタンパク質を増やす—サンプル調製時に使用するライセートバッファーの容量を減らすことで、SDS-PAGEを実施する際に同じ容量をアプライしてもより多くの量のタンパク質をロードすることができます。
- 高感度化学発光基質を使用する—使用できるサンプル量に制限がある場合でも(貴重なサンプルである、量が少ない等)、微量なタンパク質を検出することができます(詳細は当社ブログ記事をご覧ください)。
- 目的タンパク質を濃縮する—ウェスタンブロット(WB)の前に免疫沈降(IP:Immunoprecipitation)を実施して、目的のリン酸化タンパク質をあらかじめ濃縮します。
リン酸化誘導が不十分であることが原因となり、リン酸化タンパク質のシグナルが弱くなっている場合もあるため、その可能性も検討してください(「1. 目的タンパク質がいつどのようにリン酸化されるか把握する」参照)。
9. マルチプレックス蛍光ウェスタンブロット—蛍光標識色素を使用する
メンブレンのストリッピング処理を実施する場合、メンブレンからタンパク質の損失が生じる可能性があります。そのため、ストリッピング処理を実施してリン酸化タンパク質を定量する手法は、理想的な方法とは言えません。蛍光ウェスタンブロットは、同一メンブレン上で複数のバンドを検出することができる手法であるため、この問題の回避に有効です。マルチプレックス蛍光ウェスタンブロットを実施する場合は、2種類の異なる動物種由来のトータルタンパク質を検出する抗体とリン酸化タンパク質を検出する抗体が必要となります。両方の抗体と各目的タンパク質を結合させた後、蛍光標識二次抗体を使用してタンパク質を検出します。
トータルタンパク質とリン酸化タンパク質の検出に同じ動物種由来の抗体を使用している場合は?
プロテインテックの「FlexAble(フレクサブル)抗体標識キット」を使用して、一次抗体を直接的に蛍光標識することを検討してください。同じ動物種由来の抗体を用いる場合においても、迅速かつ簡便にマルチプレックス蛍光ウェスタンブロットを実施できます。
著者:Cali Anderson
プロテインテック テクニカルスペシャリスト
関連情報
Western blot products overview
Tag & loading control antibodies
SignalBright Chemiluminescent Substrate
関連コンテンツ
Lysate Preparation: How Do I Optimize My Extraction?
Why Does The Observed Protein Molecular Weight (MW) Differ From The Calculated One?
Loading Control Antibodies for Western Blotting
Detecting low abundance proteins via Western Blot
Proteases for Western Blotting: Choosing the right tools for the job
How to save time on your immunoassay experiments



