特集 : mRNAプロセシング
RNAプロセシングは、遺伝子発現の転写後調節のために重要です。
はじめに
RNAプロセシングは、遺伝子発現の転写後調節のために重要であり、タンパク質発現の律速段階です。RNAプロセシングの大部分は転写と同時に起こり、この段階で複数のプロセス(mRNAキャッピング、スプライシング、エディティング、3'末端形成)を経て新生メッセンジャーRNA(mRNA)分子が形成されます。これらのプロセス全体で、様々な酵素とタンパク質がmRNA転写産物の安定化に重要な役割を果たします。
コーディングmRNAとノンコーディングmRNA両方のRNAは、共転写調節の他、転写後レベルでも調節を受けることがあります。約150種類のRNA修飾が知られていますが、それらの発生と機能に関する我々の知識は未だ限られています。そうとは言え、確かなことが1つあります。それは、遺伝子発現の転写後調節が以前考えられていたよりもはるかに複雑であるということです。その内部の仕組みを解明することは、遺伝子発現の全体像の理解に不可欠であり、多数の遺伝病や癌における転写後機能異常に関する貴重な洞察をもたらします。本ページ記載のカタログには、RNAプロセシングのいくつかの側面に関与するタンパク質を標的とする抗体のうち、この領域の発見に携わる研究者のために精選したものを収載しています。
CIRBP
温度の急激な低下等の細胞ストレスの結果として、低温ショックタンパク質の転写、翻訳、およびスプライシングに関与するいくつかのタンパク質が発現します。低温誘導性mRNA結合タンパク質CIRBP(別名:A18HNRNP、CIRP)は、遺伝子転写物を低酸素、低体温、紫外線などの遺伝毒性ストレス因子から保護する上で重要な役割を果たします。細胞がストレスを受けると、CIRBPは核から細胞質に移行することができ、そこでmRNAを安定化する働きをします。
近年、CIRBPは、頭頸部癌のほぼ95%を占める最も一般的なタイプの悪性腫瘍である口腔扁平上皮癌(OSCC)と関連付けられました。Renらの研究は、OSCC患者におけるCIRBPおよびToll様受容体4(TLR4)の発現の上昇を示しました。
これまでに、CIRBPは、TLR4を介して炎症作用を誘導することが示されています。慢性的な炎症がOSCCの発症の一因ですが、この疾患の発症機序はまだ十分に解明されていません。TLR4の活性化によって慢性炎症が誘導されることがあり、それによって腫瘍増殖が促進されることが示唆されています。
Renらは、プロテインテックのCIRBPに対する抗体(カタログ番号:10209-2-AP)を使って、OSCC患者と対照被験者から得た生検サンプルを選択し、CIRBPとTLR4の発現について分析しました。彼らは、患者の37.7%でCIRBPが過剰発現し、さらに62.3%で低発現であったことを実証することができました。それに対して、対照患者の組織は、TLR4発現もCIRBP発現も示しませんでした。著者らはこれに加えて、OSCC患者の生存率とCIRPまたはTLR4の過剰発現との関係の比較を試みました。どちらかのマーカーが過剰発現していると、予後が有意に不良であることが示されました。考えられる1つの原因に、OSCC症例の根本的発症機序にCIRBPが最初から関与することがありますが、CIRBPはTNF-αが誘導するアポトーシスに対する防御を担うという報告もあります。したがって、CIRBPはOSCCに延命効果をもたらす可能性もあります。
この研究からの知見は、CIRBPまたはTLR4、あるいはその両方がOSCCの発症において重要な生物学的役割を担うという仮説を支持するものです。さらに、それらは将来、患者の転帰を予測する診断マーカーとなる可能性があります。
|
KD/KO 検証済み 72 文献 カタログ番号: 10209-2-AP 抗体タイプ: Rabbit Polyclonal アプリケーション: ELISA, WB, RIP, IP, IHC, IF, FC, CoIP
|
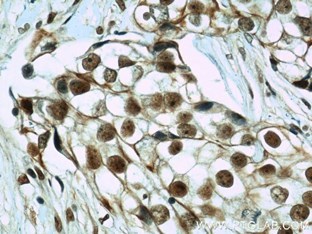
右:CIRBP抗体(カタログ番号:10209-2-AP、希釈倍率:1:50)を使用したパラフィン包埋ヒト乳癌の免疫組織化学染色結果(40倍レンズ下)。 |
RTCB
小胞体(ER:endoplasmic reticulum)は、真核細胞に見られるオルガネラの一種であり、滑面ERと粗面ERの2つのタイプがあります。2種類のERは、主にタンパク質のフォールディングと新たに合成されたタンパク質のゴルジ体への輸送を支援する働きをします。ER内に見られるタンパク質フォールディングネットワークは、小胞体ストレス応答(UPR:unfolded protein response)によって維持されています。UPRは、3つのシグナル伝達分岐経路から成り、機能するAFT6、PERK、およびIRE1の主要酵素によって識別されています。UPRのIRE1分岐経路は、ERストレス時にXBP1のmRNAのスプライシングを開始します。XBP1は重要なUPR転写因子です。
スプライシング時、IRE1-αと呼ばれる酵素がXBP1転写物の唯一のイントロンを切断して、ライゲーションを要する残り2つのエクソンを残しますが、これを行う酵素の正体は、2014年9月にMolecular Cellの論文が発表されるまで謎でした。
Molecular Cellの論文でLuらはプロテインテックの抗RtcB抗体(カタログ番号:19809-1-AP)を使って、長らく不明であったUPR時のXBP1の両エクソンの結合に不可欠なRNAリガーゼがRtcBであることを示しました。著者らは、RtcBがIRE1-αの下流で作用することを示し、これがイントロン配列の除去後に起こることを実証しました。さらに、RtcBノックアウト細胞では、ERストレス時のXBP1 mRNAのスプライシングが不完全であり、遺伝子レスキュー後に修復されます。
著者らは、UPR時に起こるスプライシングを担うリガーゼがRtcBであることを実証することができました。この経路は現在、神経変性疾患において非常に重要であると考えられています。
| 抗体名 | カタログ番号 | 抗体タイプ | アプリケーション |
| RTCB | 19809-1-AP | ウサギポリクローナル | ELISA, WB, IP, IF |
SF3B3
mRNA合成時、2段階のプロセスによって、mRNAスプライシングは核プレmRNAからイントロンを除去します。このプロセスは、スプライソソームと呼ばれるリボヌクレオタンパク質複合体で起こり、スプライシング因子3b(SF3B3)等いくつかのタンパク質の相互作用を必要とします。
SF3B3は、スプライシング因子3Aと12s RNAユニットと共にU2 snRNP(U2核内低分子リボ核タンパク質:U2 small nuclear ribonucleoproteins)複合体を構成します。この複合体は、他のU snRNPと共にプレmRNA基質に動員されて、スプライソソームを構築します。これらはATP依存的再構成を経て、E、A、B、Bact、B*、およびC複合体と呼ばれる中間体を形成します。なお、明確に定義された化学状態で複合体を停止させることができなかったこともあり、これらの相互作用が全て特徴付けされているわけではありません。
Ilaganらは最近の発表において、ヒトのスプライソソームを新しい触媒後状態(P複合体と命名)で停止させる方法を考案しました。P複合体ユニットとC複合体ユニットとを定量的に比較したところ、スプライソソームのSF3b成分の増加と、RNA依存的ATPaseであると推定されるDHX35の損失が示されました。著者らはプロテインテックの抗SF3B3抗体(カタログ番号:14577-1-AP)と彼らの新しいスプライソソーム停止法を使って、ヒトのスプライソソームのスプライシング前後のスナップ写真を撮りました。Ilganらの業績はスプライソソームの活性部位近傍の再構成の観察への新たな窓を開き、エクソンライゲーションとmRNA放出の内部の仕組みを見るこができるようになりました。
| 抗体名 | カタログ番号 | 抗体タイプ | アプリケーション |
| SF3B3 | 14577-1-AP | ウサギポリクローナル | ELISA, WB, RIP, IP, IHC, IF, CoIP |
その他関連製品
| 抗体名 | カタログ番号 | 抗体タイプ | アプリケーション |
| DHX35 | 24923-1-AP | ウサギポリクローナル | ELISA, IHC |
| SF3A1 | 15858-1-AP | ウサギポリクローナル | ELISA, WB, IP, IHC, IF |
| SF3A2 | 15596-1-AP | ウサギポリクローナル | ELISA, WB, IP, IHC |
| SF3A3 | 12070-1-AP | ウサギポリクローナル | ELISA, WB, IP, IHC, IF |
METTL3
メチルトランスフェラーゼ様3(別称:METTL3)は、mRNA中のアデノシン塩基の転写後メチル化に関与する酵素であり、その作用によりN6メチルアデノシン(m6A)が形成されます。この修飾形態は、哺乳類のmRNAとノンコーディングRNAで最も多い内部修飾です。RNA免疫沈降法の後、次世代シーケンシングを行ったところ、7,000を超えるmRNAと2,000を超える長鎖ノンコーディングRNAがm6A部位を含み、これらが停止コドンに位置することが最も多いことが明らかになりました³。m6A-メチルトランスフェラーゼの正確な生物学的機能は十分に特徴付けされていませんが、これまでに得られたエビデンスは、胚発生、配偶子形成、および幹細胞の自己複製に関与することを示しています。
METTL3は、m6A形成に関与するもう一つの酵素であるMETTL14とも相互作用します。METTL3とMETTL14との相互作用は、ヘテロダイマー複合体の形で起こり、その結果核RNAにm6Aが沈着します。この知見を報告した論文は、プロテインテックのMETTL3を認識する抗体(カタログ番号:15073-1-AP)についても述べています。Liuらはゲルろ過を使用して、METTL3とMETTL14が安定なヘテロダイマー複合体をin vitroで形成することを示すことができました。さらに、HeLa細胞におけるMETTL3、METTL14、およびWTAP(ウィルムス腫瘍1関連タンパク質)のRNA干渉ノックダウンにより、RNAへのm6A付加がそれぞれ30%、40%、および50%減少することを示しました⁴。さらなる研究により、METTL3とMETTL14の両者がメチルトランスフェラーゼ活性を示すものの、METTL14はMETTL3よりも大幅に高い酵素活性を示すことが示されました。
要するに、著者らは、新たに発見されたメチルトランスフェラーゼMETTL14が、METTL3と共に安定な複合体を形成し、これがRNAにm6Aを沈着させるように働き、METTL3/METTL14複合体と相互作用するWTAPは細胞m6A沈着を調節することを示しました。さらに、この活性はWTAPによって調節されます。この新しいメチルトランスフェラーゼ複合体の解明は、遺伝子発現調節における新たな標的を立証し、健康および疾患におけるmRNAメチル化の目的の解明に寄与する可能性があります。
| 抗体名 | カタログ番号 | 抗体タイプ | アプリケーション |
| METTL3 | 15073-1-AP | Rabbit poly | ELISA, WB, RIP, IP, IHC, IF, FC, CoIP, ChIP |
mRNAプロセシングカタログをダウンロード(PDF) |