間葉系幹細胞(MSC)は真の幹細胞なのか?
MSCは、組織工学にとって大きな可能性と、臨床的重要性を秘めています。この細胞は、異なる種類の組織に分化することができる成体の多分化能性(multipotent)細胞です。
1)間葉系幹細胞(MSC:mesenchymal stem cell)とは?
MSCは、多分化能性幹細胞(multipotent stem cells)です。MSCについて判明していることは次の通りです(1):
- 1960~70年代にAlexander Friedenstainによって発見される。
- 主に骨髄に存在する多分化能性細胞である。
- その主な機能は、軟骨や骨等の骨組織の形成および修復である。
- プラスチック接着性の細胞群と定義される。
- 細胞や細胞を使った遺伝子治療のツールとして最も有力視されている。
造血幹細胞(HSC:hematopoietic stem cell)と同様に、MSCは、骨髄にも存在します(0.001~0.01%)(1)。MSCは、幅広いアプリケーションへ適用できる可能性を秘めているため、一般的に「多系統細胞(multi-lineage cells)」として知られています。例えば、構造組織や結合組織の再生、骨の修復(2)、軟骨の修復(3)、血管新生の刺激(4)(心筋梗塞発症後)、免疫調節作用による炎症および瘢痕化の軽減(5)等が知られています。また、MSCは、脂肪組織、羊膜、滑液、筋肉、真皮、乳歯、臍帯組織にも認められます。ドナーから提供を受ける細胞数では、完全な成熟臓器を作製するには不十分です。このため、MSCを特定の条件の培地と特異的増殖因子を使用してin vitroで培養および増殖させる必要がありますが、8~10回継代すると老化現象を呈するため、それを回避する代替法の開発も望まれています(1,6)。MSCは、様々な細胞に分化することができる多分化能性幹細胞であり、主に脂肪細胞、筋細胞、軟骨細胞、骨細胞の4種類に分化します(図1)。MSCの形態は、細長く、薄く、広く分散した特徴を示します。MSCは他の幹細胞に比べて自己複製能力が高く、免疫抑制能も有しているため、移植片対宿主病(GVHD)、再生不良性貧血(AA)、クローン病(CD)、関節リウマチ(RA)、多発性硬化症(MS)等の免疫疾患における臨床的効果が期待されます(13)。
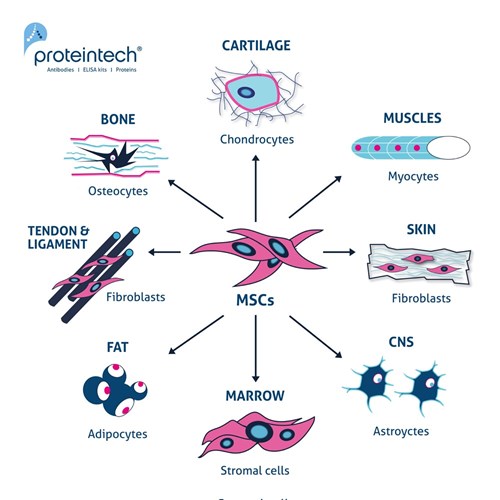
図1. MSCの多分化能。様々な誘導剤(例:サイトカイン、増殖因子)に曝露することで、MSCは軟骨細胞、筋細胞、線維芽細胞、星状細胞(アストロサイト)、間質細胞、脂肪細胞、骨細胞に分化することができる。
2)間葉系幹細胞:名称を変えるべきか?
一般的に、MSCは、自己複製が可能で間葉系の様々な組織へ分化できることから、真の意味での幹細胞であると考えられています(6)。しかし、MSCは、未分化状態ではありますが、あくまで特定の種類の細胞に分化する前の細胞であるという見解もあり、真の幹細胞と言えるかどうかについては議論されています。図2は、胚性幹細胞(ESC:embryonic stem cell)と人工多能性幹細胞(iPSC:induced pluripotent stem cell)の分化経路を詳細に示しています。ESCとiPSCは、外胚葉系、中胚葉系、内胚葉系に分化します。
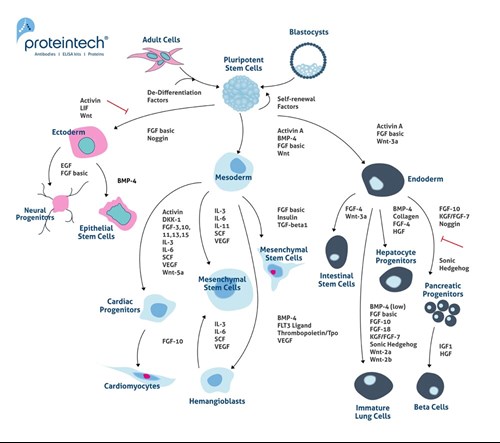
図2. 胚性幹細胞(ESC)と人工多能性幹細胞(iPSC)の分化経路。ESCとiPSCは、外胚葉系、中胚葉系、内胚葉系に分化する。
3)間葉系幹細胞(MSC)の分化には、どのような増殖因子やサイトカインが必要か?
MSCは、培養条件に応じて、様々な系統特異的な細胞に変化します。これらは、主に筋細胞、軟骨細胞、骨細胞、脂肪細胞の4種類の細胞に分化します。表1には、分化過程で必要とされる重要な増殖因子をまとめています。
|
細胞型 |
分化に使用される増殖因子 |
|
筋細胞(Myocyte) |
|
|
軟骨細胞(Chondrocyte) |
|
|
骨細胞(Osteocyte) |
|
|
脂肪細胞(Adipocyte) |
表1. MSCが特定の細胞に分化するために必要な増殖因子。
4)間葉系幹細胞(MSC)はどのように組織再生に貢献するのか?
骨
組織修復や創傷治癒に対するMSCの潜在能力は広く知られています。MSCとMSCから分化した前駆細胞がin vivoおよびin vitroの特定の条件下で軟骨細胞へ分化できるということは、これまでにも多くの文献で示されています(2)。さらに、これらの細胞は非免疫原性であるため、MSCの同種移植ではレシピエントの免疫抑制を必要としません(7)。これまでの研究で、ヒト骨髄由来のMSCを骨折部位に移植すると、骨修復が認められることが、動物モデルを使用した複数の実験で示されています(7,8)。さらに、死亡率の増加、入院期間の延長、費用の増加につながるヒトの難治性骨折(偽関節)でも、経皮的骨髄移植による治療が行われています(7,9)。
軟骨
MSCは、軟骨を修復することができます。実際、培養条件に応じて、MSCは軟骨細胞に分化し、軟骨形成を誘導することが可能です(3)。インスリン様成長因子-1(IGF-1)とトランスフォーミング増殖因子-β1(TGF-β1)(カタログ番号:HZ-1011)を、単独で、またはこの2つを一定量添加し続けると、軟骨形成期において骨膜間葉系細胞の増殖と分化を調節する可能性が示されています(3)。
心臓組織
心血管疾患は、世界的に見て、がんに次いで2番目に多い死因となっています。生活習慣への介入や予防対策とは別に、信頼のおける治療法を発見する必要があります。MSCは、急性心筋梗塞後のリモデリングに影響を与え、損傷を受けた心筋組織の再生を刺激し、冠動脈の血管新生を誘導します(10)。さらに、機能細胞への完全な分化はまだ達成されていないものの、MSCは心臓の細胞にも分化することができます。MSCが心臓の細胞に分化すれば、傷害心筋の機能を補足する代替戦略として使用でき、最終的には細胞心筋形成術に応用できる可能性があります(11)。
5)間葉系幹細胞(MSC)の今後の展望は?
MSCの利用は、米国食品医薬品局(FDA)の承認を得る必要があります。現在、このプロセスは、免疫抑制効果の結果に一貫性がなく、細胞の品質にばらつきがあり、試験計画の一貫性の欠如、投与量のばらつき、異なる投与方式で試みられているといった理由により、遅延しています(12)。
現在の課題の1つは、MSCの系統特異的な成熟細胞への分化を制御することです(12)。分化現象のメカニズムを解明するためには、よく知られている増殖因子(例:FGF basic(カタログ番号:HZ-1285)、FGF-4(カタログ番号:HZ-1218)、IL-6(カタログ番号:HZ-1019)、PDGF-bb(カタログ番号:HZ-1308))や、これら因子とMSCの相互作用についてさらに調査する必要があります。チェックポイントの制御を達成して初めて、ヒトにおける様々な細胞治療でMSCの潜在能力を最大限に活用することができるようになります。
参考文献
- F. P. Barry, J. M. Murphy. Mesenchymal stem cells: clinical applications and biological characterization. Int J Biochem Cell Biol. 2004 Apr;36(4):568-84.
- U. Nöth, et al. Multilineage mesenchymal differentiation potential of human trabecular bone‐derived cells. J Orthop Res. 2002 Sep;20(5):1060-9.
- T. Fukumoto, et al. Combined effects of insulin-like growth factor-1 and transforming growth factor-β1 on periosteal mesenchymal cells during chondrogenesis in vitro. Osteoarthritis Cartilage. 2003 Jan;11(1):55-64.
- C. Merino-González. et al. Mesenchymal Stem Cell-Derived Extracellular Vesicles Promote Angiogenesis: Potencial Clinical Application. Front Physiol. 2016 Feb 9;7:24.
- Y-M. Pers, et al. Mesenchymal stem cells for the management of inflammation in osteoarthritis: state of the art and perspectives. Osteoarthritis Cartilage. 2015 Nov;23(11):2027-35.
- K. Hynes, et al. Generation of functional mesenchymal stem cells from different induced pluripotent stem cell lines. Stem Cells Dev. 2014 May 15;23(10):1084-96.
- A. H. Undale, et al. Mesenchymal Stem Cells for Bone Repair and Metabolic Bone Diseases. Mayo Clin Proc. 2009 Oct; 84(10): 893–902.
- S. P. Bruder, et al. Bone regeneration by implantation of purified, culture-expanded human mesenchymal stem cells. J Orthop Res. 1998 Mar;16(2):155-62.
- Ph. Hernigou, et al. Percutaneous autologous bone-marrow grafting for nonunions. Influence of the number and concentration of progenitor cells. J Bone Joint Surg Am. 2005 Jul;87(7):1430-7.
- A. N. Patel, Eds. Mesenchymal Stem Cells. Stem Cell and Gene Therapy for Cardiovascular Disease. Academic Press. 2016 pp.139-150.
- C. Toma, et al. Human Mesenchymal Stem Cells Differentiate to a Cardiomyocyte Phenotype in the Adult Murine Heart. Circulation. 2002 Jan 1;105(1):93-8.
- F. Gao, et al. Mesenchymal stem cells and immunomodulation: current status and future prospects. Cell Death Dis. 2016 Jan; 7(1):e2062.
- Q. Zhao, et al. Mesenchymal stem cells: Immunomodulatory capability and clinical potential in immune diseases. Journal of Cellular Immunotherapy. 2016 Mar;2(1):3-20.


