ヒト細胞発現タンパク質が臨床研究アプリケーションに優れている理由
ヒト細胞による人のためのタンパク質
ヒト細胞発現系タンパク質が臨床研究アプリケーションに優れている理由
DNAの挿入、編集、消去という20世紀の分子生物学におけるブレイクスルーは、医療の新たな可能性を生み出しました。この新たな可能性の成功事例には、扱いやすい宿主を利用した活性型ヒトタンパク質の作製が挙げられます。初期の有名な例は、Genentech(ジェネンテック)社による組換えインスリン生産を目的とした大腸菌の使用です(1)。
生物学や医学の変遷に伴い、組換えタンパク質のニーズも変化してきました。活性を発揮するために、多くのタンパク質は真核生物系でしか得られない糖鎖修飾やプロセシングを必要とします。このため、組換えタンパク質の発現系として、昆虫細胞やチャイニーズハムスター卵巣(CHO)細胞が開発されることになりました。
科学や医学の進歩に伴い、組換えタンパク質の生産システムは増大するニーズに対応するために奮闘しています。例えば、ヒト幹細胞技術やCAR-T細胞療法では、動物由来成分や異種由来成分を含まない培地が求められますが、同時に高い活性と拡張性を備えている必要があります。
ヒトへのアプリケーションや臨床研究のためには、ヒト細胞の発現系が理想的です。プロテインテックのHumanKine®組換えタンパク質は、すべてHEK293細胞を用いて産生されており、臨床研究の新たなニーズを満たしています。
プロテインテックのHumanKine® サイトカイン&増殖因子
HumanKine®製品が他の製品よりも優れている理由:
1. 動物由来成分や異種由来成分を含まない
製造のどの時点であっても、動物や動物に由来する物質を使用していません。
アニマルフリー・ゼノフリーのタンパク質の長所
|
2. タグフリー
タグを使用せずに発現させ精製しています。
タグフリータンパク質の長所:
|
3. ネイティブなフォールディングと成熟
CHO細胞や昆虫細胞は真核生物の発現系ですが、多くの場合、ヒトタンパク質をプロセシングする能力はヒト細胞の発現系と一致しません。例えば、図1はヒト細胞がCHO細胞よりも成熟したactivin A二量体を産生することを示しています。
4. ヒトネイティブの糖鎖修飾
糖鎖修飾はタンパク質の安定性と機能に極めて重要な役割を果たします。CHO細胞と昆虫細胞は、この修飾過程の機構が著しく異なり、ヒトタンパク質とはまったく異なる糖鎖修飾タンパク質を産生します。図2は、発現系間で糖鎖修飾が異なる例を示しています。
5. 高い安定性
ネイティブ型の糖鎖修飾と成熟により、ヒト細胞系で発現させたタンパク質はその他の発現系のタンパク質よりも安定性に関して非常に優れています。また、プロテインエンジニアリングにより改変し、熱安定性を高めたFGF basicを販売しています。図3は、HumanKine® FGF basicは、大腸菌由来のFGF basicよりも培養時の安定性が高いことを示しています。
6. 高い活性
上述した性質が相乗効果をもたらし、その他の発現系で産生されるタンパク質よりも高い活性を示す傾向があるタンパク質を産生します。図4では、真核生物の発現系間の複数のサイトカインの活性を比較しています。
多くのバイオテクノロジー研究の足跡をつなぐと、共通の道筋が現われます。細菌における普遍的な原理の発見—その時からヒトへ適用するという最終目標への準備が整うまでにモデル生物は進歩を遂げてきました。人為的なタンパク質の産生はこうしたパターンに従い、HumanKine®製品では、ついにヒト細胞を使用してヒトへ使用するヒトタンパク質を産生する段階にあります。
| 図1 |
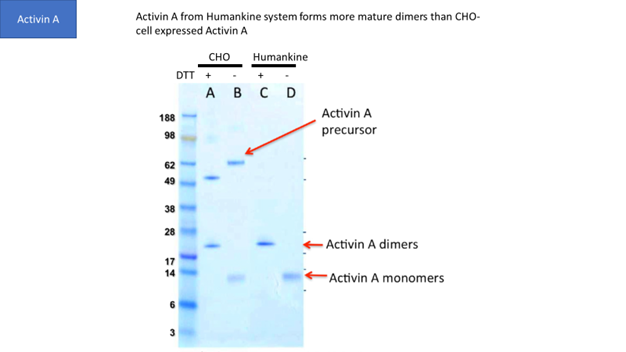 |
| CHO細胞およびHumanKine®系由来の精製Activin Aをクマシーブルー染色したSDS-PAGEゲル。成熟したアクチビンA二量体の生成を示している。 |
| 図2 |
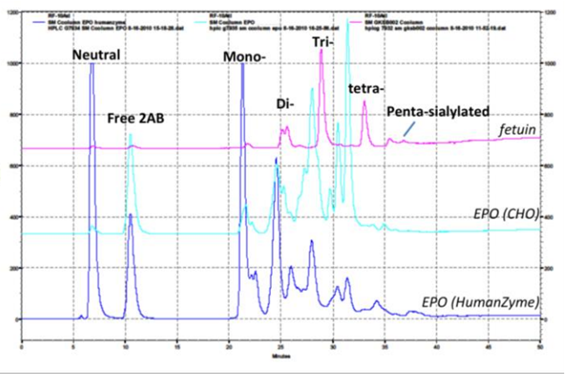 |
| ヒト細胞発現系(Humanzyme)およびCHO発現系のEPO(エリスロポエチン)の糖鎖修飾のHPLC比較。糖鎖組成に顕著な相違が認められた。Fetuin(フェチュイン)は陽性コントロールとして使用。 |
| 図3 |
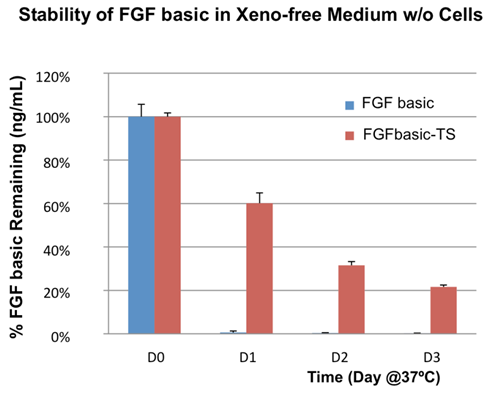 |
| HumanKine®(FGF basic-TS、カタログ番号:HZ-1285、赤)および大腸菌由来(FGF basic、青)のFGFを、培地中、37℃、無細胞でインキュベーションした場合の安定性の比較。 |
| 図4 |
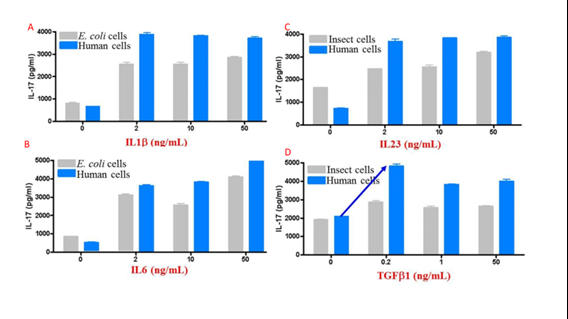 |
| 昆虫、ヒト、大腸菌の各細胞発現系でのサイトカイン(A:IL-1β、B:IL-6、C:IL-23、D:TGF-β1)の活性比較。ヒトCD4+細胞のTh17分化により決定。 IL-1β(カタログ番号:HZ-1164)、IL-6(カタログ番号:HZ-1019)、IL-23(カタログ番号:HZ-1254)、TGF-β1(カタログ番号:HZ-1011) |
関連情報
News
- Proteintech’s HumanKine® Human cell-expressed cytokines and growth factors are now available in GMP-compliant versions for use in clinical trials and commercial manufacturing.
- New GMP laboratory to focus on HumanKine® line of human cell line-derived growth factors and cytokines for use in the pharmaceutical industry
- Proteintech announces an agreement to acquire HumanZyme, a leading manufacturer of recombinant human proteins
製品
特集:注目製品
- Human serum albumin’s importance in biology and biotech
- Recombinant human protein Activin A: An Alpha in the TGF Beta Family
- GM-CSF – A modulatory cytokine in autoimmunity & inflammation
- FGF Basic TS: Thermostable FGF does not require media changes over the weekend
HumanKine®製品のすべてのリストは、以下をご参照ください:
|
製品名 |
カタログ番号 |
活性 |
純度 |
|
0.5-3.5 ng/mL EC50 |
>95% |
||
|
≤ 3 ng/mL EC50 |
>95% |
||
|
7.5-37.5 ng/mL EC50 |
>95% |
||
|
1.5-9 ng/mL EC50 |
>95% |
||
|
3.6-18.5 ng/mL EC50 |
>95% |
||
|
0.5-2.6 µg/mL EC50 |
>95% |
||
|
0.28-1.4 ng/mL EC50 |
>95% |
||
|
0.05-0.4 ng/mL EC50 |
>95% |
||
|
≤1.25 ng/mL EC50 |
>95% |
||
|
≤7.5 ng/mL EC50 |
>95% |
||
|
≤10 ng/mL EC50 |
>95% |
||
|
0.4-3.0 ng/mL EC50 |
>95% |
||
|
0.009-0.05 ng/mL EC50 |
>95% |
||
|
≤10 ng/mL EC50 |
>95% |
||
|
0.08-0.8 ng/mL EC50 |
>95% |
||
|
≤20 ng/mL EC50 |
>95% |
||
|
0.02-0.120 ng/mL |
>95% |
||
|
N/A |
>95% |
||
|
≤0.4 ng/mL EC50 |
>95% |
||
|
≤0.12 ng/mL EC50 |
>95% |
||
|
≤0.1 ng/mL EC50 |
>95% |
||
|
0.02-0.14 ng/mL EC50 |
>95% |
||
|
≤0.05 ng/mL EC50 |
>95% |
||
|
0.05-0.35 ng/mL |
>95% |
||
|
0.4-2.0 ng/mL EC50 |
>95% |
||
|
0.07-0.4 ng/mL EC50 |
>95% |
||
|
0.03-0.24 ng/mL EC50 |
>95% |
||
|
0.2-1.4 ng/mL |
>95% |
||
|
0.15-0.85 ng/mL EC50 |
>95% |
||
|
0.18-2.0 ng/mL EC50 |
>95% |
||
|
1-5 ng/mL EC50 |
>95% |
||
|
0.24-1.2 ng/mL EC50 |
>95% |
||
|
4.5-22.5 ng/mL EC50 |
>95% |
||
|
≤4 ng/mL EC50 |
>95% |
||
|
≤12 ng/mL EC50 |
>95% |
||
|
0.01-0.06 ng/mL EC50 |
>95% |
||
|
0.07-0.35 ng/mL EC50 |
>95% |
||
|
0.12-0.6 ng/mL EC50 |
>95% |
||
|
≤ 2.5 µg/mL EC50 |
>95% |
||
|
≤ 1 ng/mL EC50 |
>95% |
||
|
0.7-4.0 ng/mL EC50 |
>95% |
||
|
1.5-15 ng/mL EC50 |
>95% |
||
|
Oncostatin M(OSM) |
≤ 1 ng/mL EC50 |
>95% |
|
|
≤ 10 ng/mL EC50 |
>95% |
||
|
0.3-3 ng/mL EC50 |
>95% |
||
|
N/A |
>95% |
||
|
≤ 50 ng/mL EC50 |
>95% |
||
|
15-85 ng/mL |
>95% |
||
|
≤350 ng/mL EC50 |
>90% |
||
|
≤ 0.5 ng/mL EC50 |
>95% |
||
|
0.018-0.18 ng/mL EC50 |
>95% |
||
|
0.14-0.75 ng/mL EC50 |
>95% |
||
|
N/A |
>95% |
||
|
0.002-0.026 ng/mL EC50 |
>95% |
||
|
≤ 5 ng/mL EC50 |
>95% |
||
|
≤ 15 ng/mL EC50 |
>95% |
||
|
0.3-3.75 ng/mL EC50 |
>95% |
||
|
2-17 ng/mL EC50 |
>90% |

